توضیحات
اسید نیتریک که با نام تیزاب و جوهر شوره نیز شناخته می شود کاربرد های زیادی در صنعت دارد. شما می توانید برای خرید اسید نیتریک و اطلاع از قیمت این محصول از طریق راه های ارتباطی زیر با ما در تماس باشید. در ادامه ی متن با کاربرد های این ترکیب ( در کشاورزی و…) و همچنین خطرات و روش تولید آن بیشتر آشنا خواهید شد. پس با ما همراه باشید. این ماده برخلاف ترکیباتی مانند اسید فرمیک (خرید) که ضعیف هست, یک اسید قوی محسوب می شود.
خرید اسید نیتریک
آیا برای شما نیز سوال است که “این اسید را از کجا بخریم؟” تنها کافی است که با ما تماس بگیرید تا محصولی با کیفیت عالی و قیمت مناسب دریافت نمایید.
فروش اسید نیتریک
جهت اطلاع از قیمت ها و ثبت سفارش با ما در تماس باشید.
خواص فیزیکی و شیمیایی اسید نیتریک
| نام ها | تیزاب، جوهر شوره |
| نقطه جوش | 83 درجه ی سانتی گراد |
| دمای انجماد | -40 درجه ی سانتی گراد |
| شکل ظاهری | در دمای اتاق این محصول به صورت خالص (100%) بی رنگ
به صورت منجمد سفید رنگ است. |
| ساختار مولکولی | 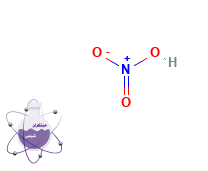 |
تولید اسید نیتریک
محصول غلیظی که از این ماده در بازار موجود است اغلب به صورت 68 درصد وزنی HNO3 در آب می باشد (محلول 16 مولار). اسید نیتریک 65 درصد به دلیل تجزیه ی فتوالکتروشیمیایی و آزاد شدن NO2 به صورت زرد کم رنگ می باشد.
برای ساخت تیزاب سلطانی از هیدروکلریک اسید و HNO3 با نسبت 3 به 1 استفاده می شود. این ماده به دلیل داشتن Cl2 آزاد و نیتروزیل کلرید (NOCl) اسیدی قوی به حساب می آید و از آن برای ساخت کمپلکس های AuCl4 و PtCl6 استفاده می نمایند.
اسید نیتریک را می توان از آمونیاک تولید نمود.
این فرایند که فرایند استوالد نامیده می شود در سال 1902 توسط ویلیام استوالد دانشمند آلمانی کشف گردید وی در سال 1909 جایزه ی نوبل شیمی را کسب نمود.
تاریخچه:
قبل از کشف این فرایند نیترات تنها از فضولات پرندگان دریایی ماهی خوار در جزایر ساحلی پرو به دست می آمد.در طی جنگ جهانی اول به دلیل محدود شدن دسترسی آلمان به اقیانوس اطلس و مشکلات حمل و نقل، این کشور با کمبود نیترات برای ساخت نیتریک اسید و استفاده از آن در ساخت مواد منفجره از جمله TNT، نیتروگلیسیرین و… رو به رو گشت. بنابراین به دنبال یافتن راه جدیدی برای ساخت این ماده ی مهم، ویلیام استوالد توانست فرایند جدیدی برای تولید این ماده کشف نماید.
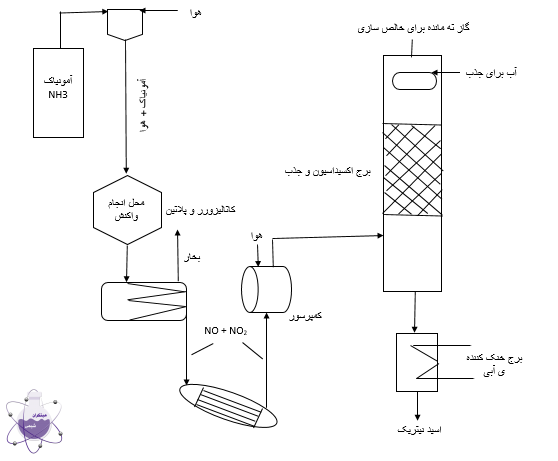
فرایند تولید
در طی این فرایند اکسیژن و آمونیاک در دمای 850 درجه ی سانتی گراد و فشار 5 اتمسفر با یکدیگر واکنش داده می شوند. برای سریع تر پیش رفتن واکنش این دو ماده و تولید گاز NO از کاتالیزور پلاتین و رودیوم کمک گرفته می شود. بعد از تولید گاز NO آن را اکسید می نمایند و به NO2 تبدیل می کنند. در نهایت برای تولید نیتریک اسید NO2 را در آب حل می نمایند و HNO3 تولید می گردد.
واکنش های این فرایند را می توانید در زیر مشاهده نمایید:
4NH3+5O2->4NO+6H2O
NO+1/2O2->4NO2
3NO2+H2O->2HNO3+NO
شماتیک تولید :
کاربرد های اسید نیتریک
اسید نیتریک در کشاورزی
بیشترین استفاده از اسید نیتریک (چیزی در حدود 80 درصد) برای تولید و ساخت نیترات آمونیوم (NH4NO3) صرف می گردد. نیترات آمونیوم جز اصلی سازنده کود شیمیایی در صنایع کشاورزی است. این اسید همچنین برای تولید کودهای که فسفات های طبیعی در اسید نیتریک حل می شوند استفاده می شود.
NH3 + HNO3 -> NH4NO3 + H2O
کود های نیترات با اسیدی کردن خاک سطح pH را کاهش می دهد و نیتروژن آزاد می کند و به تقویت رشد گیاه کمک می کند. با این حال، اگر نیتروژن بیش از حد آزاد شود، می تواند باعث رشد بیش از حد شود. در نهایت، سطوح بالای نیتروژن در خاک به گیاهان آسیب می رساند و یا احتمالاً منجر به میوه دهی کم یا بدون میوه می شود.
کابرد صنایع غذایی
اسید نیتریک در تولید نیتریت های سدیم و پتاسیم که ترکیبات حاوی یون -NO2 می باشند جهت کاربرد در صنایع غذایی استفاده می شوند. سدیم نیتریت NaNO2 و با گرید خوراکی (E250) و پتاسیم نیتریت KNO2 با گرید (E249) به عنوان نگهدارنده در فرایند پردازش گوشت هایی مانند سوسیس، کالباس، انواع بیف ها، بیکن ها، همبرگر و… مورد استفاده قرار می گیرند.
وجود یون نیتریت در این فراورده ها موجب جلوگیری از رشد باکتری ها و مسمومیت های غذایی کشنده ای مانند بوتولیسم می شود. نیتریت به عنوان افزودنی به گوشت تازه نیز افزوده می شود این ماده موجب ثابت ماندن رنگ گوشت قرمز تازه می گردد. بنابراین گوشت های قرمز تازه ای که در سوپر مارکت مشاهده می گردد لزوما کشتار روز نیستند و ممکن است تنها با افزودن نیتریت تازه به نظر بیایند.
نیتریت های افزوده شده به گوشت قرمز برای جلوگیری از تغییر رنگ هنگام سرخ و یا کباب شدن در اثر حرارت به نیتروز آمین ها تبدیل می شوند. نیتروز آمین ها موادی سمی شامل گروه های NH-NO هستند که جز یکی از خطرناک ترین و اصلی ترین عوامل شناخته شده در ایجاد سرطان به حساب می آیند.
گروه های مخالف حذف نیتریت از گوشت و فراورده های آن بر این باورند که حذف این افزودنی می تواند موجب ایجاد اپیدمی مسمومیت های غذایی شود. در نتیجه امروزه بر اساس نظرات موافق و مخالف میزان وجود نیتریت در محصولات گوشتی به طور چشمگیری کاهش پیدا کرده است اما هنوز با وجود اثبات سرطانزا بودن آن در حیوانات، از آن استفاده می شود.
استخراج طلا
اسید نیتریک در خالص سازی فلزاتی مانند طلا و نقره استفاده می شود زیرا ناخالصی ها مانند متا اکسیدهای مختلف موجود در سطح طلا را حل می کند. طلا در HNO3 نامحلول است و پس از فیلتراسیون و بازیابی استخراج می شود.
دارویی
در زمینه پزشکی از اسید نیتریک در حالت خالص به عنوان ماده سوز آور برای از بین بردن زگیل و… استفاده می شود. از محلول های رقیق شده در درمان سوء هاضمه استفاده می شود.
سوخت موشک
اسید نیتریک به اشکال مختلف به عنوان اکسید کننده در موشک های سوخت مایع استفاده شده است. اسید نیتریک یک اکسید کننده قابل ذخیره است که به عنوان پیشران موشک استفاده می شود.
سایر کاربرد ها
- تهیه ی پلیمر هایی مانند پلی آمید ها ، پلی اورتان و…
- ساخت ترکیبات آلی نیتروژن دار مانند نایلون
- این ماده کاربرد های فراوانی از جمله در ساخت تیزاب سلطانی، مواد منفجره و… دارد.
- تولید رنگ و پلاستیک
- قدیمی کردن چرم و چوب
- شستشوی فلزات
خطرات
اسید نیتریک یک اکسیدکننده و خورنده ی قوی به حساب می آید. قرار گرفتن در معرض طولانی مدت در غلظت های کم یا قرار گرفتن در معرض کوتاه مدت در برابر غلظت های بالا از این ماده می تواند مشکلات سلامتی زیادی را به وجود آورد. استنشاق این ترکیب می تواند بسیار خطرناک باشد. به دلیل خاصیت خوردگی بالای این ماده برای فلزات و بافت ها توصیه می شود نکات ایمنی را هنگام استفاده از این ترکیب رعایت نمایید.
بازار جهانی فروش اسید نیتریک
ظرفیت فعلی تولید نیترات آمونیوم حدود 8500 تن است در حالی که میزان نیاز به این ماده چیزی حدود 12000 تن تخمین زده شده است.
ضمن اینکه هر سال حدود 15 درصد نیز به تقاضای این ماده افزوده می شود.
بنابراین فاصله زیادی که بین تولید و در خواست خرید این ماده وجود دارد ، سبب بیش از پیش احساس شدن کمبود واحد های تولیدی این ماده و نیاز به پر کردن خلا موجود می باشد.
خرید و فروش مواد شیمیایی را به ما در مبتکران شیمی بسپارید.















نقد و بررسیها
هنوز بررسیای ثبت نشده است.