
آمونیاک ترکیبی از هیدروژن و نیتروژن با فرمول شیمیایی NH3 می باشد. این ماده بی رنگ با بوی تند، یک دورریز نیتروژنی است که به عنوان پیش ماده مواد غذایی و کود ها مورد توجه است. این محصول به طور مستقیم و غیر مستقیم از عناصر سازنده دارو به شمار می رود و در بسیاری از محصولات تمیز کننده مورد استفاده قرار می گیرد. جهت خرید آمونیاک و همچنین استعلام قیمت فروش آن با کارشناسان ما در ارتباط باشید.
خرید آمونیاک:
موسسه مبتکران شیمی با تجربه طولانی در تامین انواع مواد شیمیایی با برترین برندهای موجود داخلی و خارجی، آماده همکاری با واحدهای تولیدی و صنعتی مختلف می باشد.
| اطلاعات محصول | CAS NO: 7664-41-7 |
| آنالیز محصول |  |
فروش آمونیاک و استعلام قیمت:
فروش عمده انواع مواد شیمیایی با بهترین کیفیت و مناسبترین قیمت، تنها کافیست از طریق تماس با کارشناسان ما سفارش خرید خود را تکمیل کنید.
آمونیاک چیست؟
آمونیاک (ammonia) با فرمول شیمیایی NH3 گازی بی رنگ با خاصیت تحریک کنندگی بالا و بوی تند و تیز است. دارای جرم مولکولی 17.031 گرم با نقطه جوش 33.34ºC است. ماده ای بی رنگ با بوی تند و به شکل خالص گازی است. آمونیاک به عنوان یک پیش ماده برای مواد غذایی، کودها و محصولات شیمیایی کاربرد دارد.
به راحتی در آب حل می شود و محلول آمونیوم هیدروکسید را می سازد که به شدت تحریک کننده است و باعث سوختگی می شود. گاز آمونیاک تحت فشار به راحتی متراکم می شود و به مایعی بی رنگ و شفاف تبدیل می شود. آن را از منابع طبیعی و مصنوعی می توان تهیه کرد.
مشخصات فیزیکی و شیمیایی :
آمونیاک به صورت خانگی و صنعتی استفاده می شود همچنین همانطور که میدانید این ماده در شکل خالص به صورت گاز بوده که برای سهولت در استفاده و همچنین حمل و نقل راحت تر، مایع شده و به صورت آمونیاک مایع مورد استفاده قرار میگیرد.در ادامه ساختار این ماده را مشاهده می نمایید.
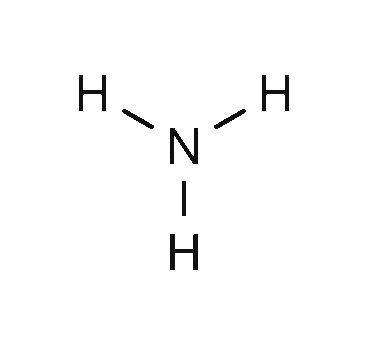
آمونیاک صنعتی معمولا به صورت محلول 28% در آب و یا تحت فشار و دمای پایین فروخته می شود. این مولکول قطبی است وتوانایی پیوند هیدروژنی آن ، باعث می شود که در آب قابل تجزیه باشد.
خواص آمونیاک
| فرمول مولکولی | NH3 |
| جرم مولکولی | 17.031 گرم بر مول |
| رنگ | بی رنگ و بوی تند |
| نقطه انجماد | -77.7 درجه سانتی گراد |
| نقطه جوش | 33.34- درجه سانتی گراد |
| حلالیت در آب | 54 گرم در هر لیتر |
روش های تولید آمونیاک :
این ماده به صورت طبیعی و صنعتی تولید می شود که در ادامه به تشریح این روش ها خواهیم پرداخت :
منابع طبیعی:
این ماده شیمیایی به مقدار کمی در طبیعت یافت می شود، نیتروژن از مواد حیوانی و گیاهی تولید می شود و نمک های آمونیوم به مقدار کم در آب باران یافت می شود. در حالی که کلرید آمونیوم به مقدار کم در مناطق آتشفشانی یافت می شود.کلیه ها برای خنثی سازی اسید اضافی آمونیاک ترشح می کنند، نمک های آمونیوم از طزیق خاک حاصلخیز و در آب دریا توزیع می شود.
روش صنعتی تولید:
محصول فوق یکی از پر مصرف ترین مواد شیمیایی معدنی است. درسال 2018 میزان تولید این ماده در کشورهای گوناگون به قرار زیر بوده است:
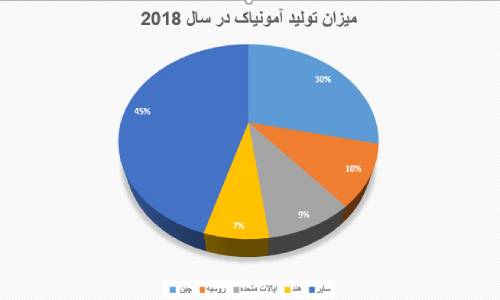
قبل از شروع جنگ جهانی اول، بیشتر آمونیاک با تقطیر خشک مواد زائد گیاهی و حیوانی ازت که با تقطیر نیتریک اسید و نیترات با هیدروژن کاهش یافته ،تولید می شد. امروزه این ماده با تقطیر زغال سنگ و تجزیه نمک های آمونیوم نیز تولید می شود.
NH4Cl + 2 CaO → CaCl2 + Ca(OH)2 + 2 NH3
در مقیاس آزمایشگاهی از حرارت اوره و کلسیم هیدروکسید می تواند تولید شود.
(NH2)2CO + Ca(OH)2 → CaCO3 + 2 NH3
اما اصلی ترین روش تولید این ماده تحت عنوان روش هاربر یاد می شود که در آن هیدروژن با یک کاتالیزور فلزی در دما و فشار بالا، نیتروژن اتمسفر را به آمونیاک تبدیل می کند.
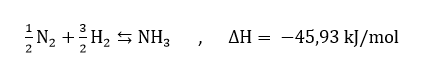
کاتالیزور های پر کاربرد در این فرآیند شامل اکسید آلومینیوم، دی اکسید سیلسیم و اکسیدهای برلیم و وانادیم هستند.
واکنش های آمونیاک
- این ماده در دمای بالا و در حضور یک کاتالیزور مناسب، به عناصر تشکیل دهنده اش تجزیه می شود.که تجزیه آن فرآیندی گرما زاست که به kcal/mol 5.5 آمونیاک نیاز دارد و هیدروژن و نیتروژن تولید می کند. می توان ازمحصول فوق به عنوان منبع هیدروژن برای سلول های سوخت اسیدی استفاده کرد. از فعال ترین کاتالیزور ها می توان به روتینوم و پلاتنیوم اشاره کرد، در صورتی که نیکل آنچنان کاتالیزور فعالی نیست.
- آمونیاک یک باز ضعیف است که با اسید ها ترکیب می شود و نمک تشکیل می دهد به طور مثال با هیدروکلریک اسید، آمونیوم کلرید؛ با نیتریک اسید، آمونیوم نیترات ساخته می شود.
- Ammunia برای ترکیب با هیدروژن کلرید و واکنش دادن نیاز به رطوبت دارد. در صورت قرار دادن بطری بازشده Ammunia غلیظ و هیدرو کلریک اسید ، ابرهای آمونیوم کلرید طبق واکنش زیر ایجاد می شود.
NH3 + HCl → NH4Cl
- اگرچه ماده مذکور یک باز ضعیف است ولی می تواند نقش یک اسید ضعیف را ایفا کند و تشکیل آمید بدهد به عبارتی آمونیاک می توان یک بافر در نظر گرفت. به طور مثال در واکنش با لیتیم ، لیتیم آمید تولید می شود.
2Li + 2NH3 → 2LiNH2 + H2
- آمین ها را می توان با واکنش بین این ماده و آلکیل هالید ها تولید کرد. به دلیل نوکلئوفیک بودن گروه NH2 آمین های نوع دوم و سوم به عنوان محصول جانبی تولید می شوند.
- واکنش سوختن آمونیاک یک واکنش گرمازاست، البته این ماده به آسانی نمی سوزد مگر در ترکیب هوا به نسبت 15-25 درصد. شعله حاصل از این واکنش سبز رنگ است
4NH3 + 3O2 → 2N2 + 6H2O (g)
ΔH°r = −1267.20 kJ
واکنش با آب:
واکنش Ammunia با آب به شرح زیر انجام می شود. این ماده به طور کامل در آب حل شده و در اثر آن گرما آزاد می شود.
NH3 + H2O ⇌ +NH4 + −OH
کاربردها
این ماده کاربردهای صنعتی و خانگی زیادی دارد در گذشته از ادرار تخمیر شده که تشکیل آمونیاک می داد برای شستن پارچه و لباس و از بین بردن مو از پوست برای آماده شدن جهت برنزه کردن و جلوگیری از زنگ زدگی آهن مورد استفاده قرار میگرفت. سایر کاربرد های این ماده به شرح زیر است :
آمونیاک در کود شیمیایی:
استفاده اصلی این ماده به عنوان کود می باشد.در سال 2019 در آمریکا، تقریبا 88 درصد از این ماده به عنوان کود یا به عنوان نمک مورد استفاده قرار گرفته است. هنگامی که این ماده وارد خاک شود، به افزایش عملکرد محصول مانند ذرت و گندم کمک میکند. 30 درصد از نیتروژن کشاورزی در آمریکا به صورت آمونیاک بی آب است و سالیانه 110 میلیون تن در جهان استفاده می شود.
ساخت ترکیبات نیتروژن دار:
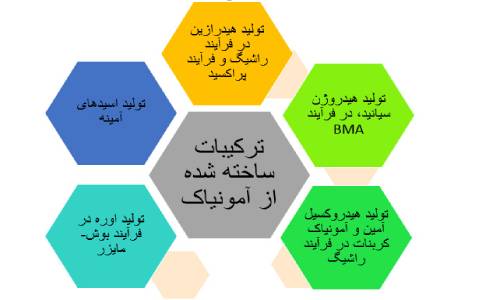
آمونیاک به طور مستقیم وغیر مستقیم در ساخت بیشتر ترکیب های حاوی نیتروژن مورد استفاده قرار می گیرد. یکی از ترکیبات تولیدی اسید نیتریک است که برای تولید کودها، مواد منفجره و … استفاده می شود. سایر ترکیباتی که این ماده در تولید آنها نقش دارد در شکل زیر نشان داده شده است:
همچنین این ماده در تولید محصولاتی از قبیل نیترات آمونیوم، تتروکسید دی نیتروژن، اتانول آمین ها ، هگزامتیلن تترا آمین و بی کربنات آمونیوم نیز استفاده می شود
استفاده برای شستشو:
آمونیاک خانگی محلول NH3 در آب است.که به عنوان تمیز کننده عمومی برای سطوح مورد استفاده قرار می گیرد. به دلیل اینکه شفافیتی ایجاد میکند رایج ترین تمیز کننده برای تمیز کردن شیشه، ظروف چینی و فولاد ضد زنگ می باشد همچنین از این ماده برای تمیز کردن کوره ها برای حذف باقی مانده ذرات مورد استفاده قرار می گیرد. غلظت این ماده در استفاده خانگی از نظر وزنی 5 تا 10 درصد است.رقیق نکردن این محصول با آب و استفاده از آن به صورت خالص می تواند با آسیبهای شدید و سوختگیهای پوستی همراه باشد.
استفاده در تخمیرکننده ها:
محلول های آمونیاک از 16 تا 25 درصد به عنوان یک تخمیر کننده صنعتی به عنوان منبع نیتروژن میکروارگانیسم ها و تنظیم pH در هنگام تخمیر مورد استفاده قرار می گیرد.
عامل ضد باکتری برای محصولات غذایی
در سال 1868 مشخص شد که محصول مذکور به شدت ضدعفونی کننده است. درحال حاضر آمونیاک بی آب برای از بین بردن آلودگی میکروبی گوشت گاو استفاده می شود.
اصلاح انتشار گازها:
از امونیاک برای پاکسازی SO2 حاصل از سوخت های فسیلی استفاده می شود و محصول حاصل برای استفاده به عنوان کود، به سولفات آمونیوم تبدیل می شود.این ماده، آلاینده های اکسید نیتروژن که توسط موتورهای دیزلی تولید می شود را خنثی می کند که این فرآیند کاهش کاتالیزوری انتخابی نامیده می شود(SCR).
کاربرد به عنوان سوخت:
چگالی انرژی خام آمونیاک مایع MJ/L 11.5 میباشد که این مقدار در گازوئیل یک سوم است. به همین دلیل تولید هیدروژن از این ماده، فرصتی ایجاد می کند تا در سلول های سوختی هیدروژن یا مستقیما در سلول های سوختی با درجه حرارت بالا استفاده شود. تبدیل محصول فوق به هیدروژن از طریق فرآیند سدیم آمید برای مصارفی همچون احتراق و یا برای سوخت در سلول های غشایی تبادل پروتون مورد استفاده قرار می گیرد.
تبدیل به هیدروژن حدود 18 درصد در مقایسه با گاز هیدورژن تحت فشار (5 درصد) صورت می گیرد و هزینه ی بسیار کمتری نسبت به هیدروژن که باید فشرده نگهداشته شود خواهد داشت .
موتور های آمونیاک با استفاده از شکل مایع Ammunia می توانند کار کنند به دلیل نداشتن اتم کربن، سوخت این ماده آلاینده هایی همچون کربن دی اکسید و مونو کسید کربن یا دوده تولید نمیکند و همچنین به دلیل عدد اکتان بالا (120) و دمای شعله بالا، این ماده یک گزینه مناسب برای استفاده به جای سوخت های فسیلی می باشد.
در موتور های موشکی هم از ماده مذکور به عنوان سوخت استفاده می شود شاید به اندازه سوخت های دیگر قدرتمند نباشد ولی دوده ای در موتور موشکی تولید نمیکند و چگالی آن با اکسید کننده ها و اکسیژن مایع تطابق دارد که طراحی هواپیما را ساده می کند.
آمونیاک به عنوان محرک تنفسی:
بخار آزاد شده از این ماده به عنوان یک محرک تنفسی استفاده قابل توجهی پیدا کرده است. متآمفتامین یک ماده ی غیر قانونی است که از این ماده تولید می شود ولی در روش تولید این ماده فلزات قلیایی و آمونیاک کنار هم قرار می گیرند که به دلیل دمای بالای این ماده هنگام افزودن واکنش دهنده ها ممکن است انفجار رخ دهد.
کاربرد در تولید خنک کننده ها:
به دلیل ویژگی های تبخیر آمونیاک، ماده مفیدی برا خنک کنندگی است. این ماده پیش از محبوبیت کلرو فلور کربن ها مورد توجه بوده است.محصول فوق به صورت خشک به دلیل بهره وری بالای انرژی و هزینه کم در کاربردهای برودتی صنعتی مورد استفاده قرار می گیرد.
سایر کاربردها:
سایر کاربردهای این ماده که موارد استفاده محدودتری دارند شامل :
- منسوجات:
از آمونیاک مایع برای تصفیه پنبه مخصوصا در شستن پشم استفاده می شود و همچنین برای ساخت الیاف مصنوعی همچون نایلون و ریون استفاده می شود.
- گاز بالابر:
در دما وفشار استاندارد، این ماده چگالی کمتری نسبت به جو دارد و حدود 47 درصد قدرت بالابرندگی هیدروژن و هلیوم را دارد.
- صنایع چوب:
این محصول برای تیره سازی چوب های سفید همانند بلوط استفاده می شود. بخارات آمونیاک با ذرات موجود در چوب واکنش داده و باعث تغییر رنگ آن نمی شود.
خطرات آمونیاک:
- در تماس باچشم ممکن است عوارضی همچون درد، قرمزی و آب آوردن ایجاد کند. بعد از تماس چشم با این ماده، با مقدار آب زیادی شسته شود.
- هنگام تماس و برخورد با پوست باعث درد، سوزش، قرمزی و در مواردی باعث سوختگی می شود.
- در صورت استنشاق، فرد مسموم شده را در معرض هوای تازه قرار دهید.
- بلعیدن این ماده در ناحیه شکم ممکن است باعث درد شدید شود.
اداره ایمنی و بهداشت شغلی آمریکا میزان قرار گیری بدون ضرر در محیطی با غلظت ppm 35 را 15 دقیقه و میزان در معرض بودن در محیطی با غلظت ppm 25 را 8 ساعت در نظر گرفته است. آمونیاک یک مایع خطرناک است چون رطوبت ساز است و باعث سوختگی های سوزاننده می شود.
تاثیرات زیست محیطی:
تولید زباله باید تا حد امکان به حداقل برسد، دفع محلول ها و هرگونه محصول جانبی باید مطابق با الزامات قانون حفاظت از محیط زیست صورت گیرد.
Ammunia حتی در غلظت کم هم برای حیوانات آبزی سمی است و به همین دلیل برای محیط زیست خطرناک می باشد. این ماده برای موجودات آبزی میتواند مشکلاتی مانند کاهش باروری و رشد ضعیف بوجود آورد.
شرایط نگهداری
- این ماده پایدار است و در شرایط نرمال نگهداری، واکنش های مخرب و مضری رخ نمی دهد
- از منابع احتراق احتمالی (جرقه یا شعله) باید دور باشد وظروف را تحت فشار، برش،جوشکاری، لحیم کاری را قرار ندهید
- از مواد ناسازگار همانند اکسید کننده ها و فلزات زرد همانند برنج و مس دوری باشد
- ظرف نگهداری ماده را به طور قائم قرار دهید
- از کشیده شدن، غلتاندن و یا کشیدن سیلندر ها خودداری کنید، برای حمل و نقل از جرخ دستی استفاده کنید
- در مکانی که تهویه مناسب دارد نگهداری کنید
پرسش و پاسخ:
در انتها لازم است به چند سوال و نکته مهم پیرامون این ماده پاسخ دهیم.
ترکیب با سفید کننده ممنوع!
یکی از مواردی که همواره نفی می شود ترکیب محصولات پاک کننده با یکدیگر است، بیشترین خطری که ممکن است در زمان استفاده از این ماده با آن مواجه باشید استنشاق گاز کلرآمین ناشی از ترکیب کردن سفید کننده های حاوی کلر با آمونیاک است، این گاز سمی بوده و تنفس آن باعث بروز آسیب های جدی به مجاری تنفسی خواهد شد، بنابراین اگر به سلامتی خود اهمیت می دهید جمله ی ترکیب با سفید کننده ممنوع را همواره به خاطر داشته باشید.
اهمیت سنجش آمونیاک خون به چه علت است؟
از آنجایی که این ماده در خون نیز وجود دارد باید میزان آن به صورت دوره ای از طریق آزمایش بررسی و کنترل شود. مقدار مجاز آمونیاک در خون معادل 15 تا 45 میکروگرم به ازای هر دسی لیتر بوده و مقادیر بالاتر می تواند سبب ضعف حافظه،فشار خون، تشنج و حتی اغما گردد.
سوالات متداول
کاربرد آمونیاک چیست؟
تقریبا بیش از 80 درصد آمونیاک تولیدی در صنعت در کشاورزی به عنوان کود مصرف می شود. همچنین به عنوان گاز یخچال، خالص سازی آب، تولید پلاستیک، رنگ، محلول های شوینده خانگی و صنعتی کاربرد دارد.
آمونیاک چه تاثیری روی بدن انسان ها دارد؟
آمونیاک می تواند از طریق استنشاق، بلع یا تماس با پوست وارد بدن شود. این ترکیب در صورت تماس با بدن به شدت خورنده و خطرناک است.
عوارض آمونیاک چیست؟
آمونیاک ترکیبی به شدت خورنده است. غلظت بالای این ماده می تواند سوختگی چشم ها، بینی و گلو را به دنبال داشته باشد. حتی می تواند باعث مرگ شود.


