خوردگی (Corrosion) عملی است که در آن ماده ای در یک محیط دچار تخریب و از بین رفتگی می شود . این قضیه برای تمام مواد صادق است ، اما معمولا خوردگی در مورد فلزات شناخته شده تر است . در ادامه به شرح و توضیح این فرآیند خصوصا در فلزات خواهیم پرداخت :
خوردگی فلزات
مواد فلزی که در جو و محیط های آبی قرار دارند عموما در معرض خوردگی قرار می گیرند . خوردگی فلزات یکی از مشکلاتی است که همواره باعث ایجاد مشکلاتی در صنعت می گردد ، بنابراین از زمان انقلاب صنعتی در اوخر قرن 18 میلادی مورد بررسی و تحقیق قرار گرفته است . علم مدرن در اوایل قرن بیستم با مدل سلول محلی (local cell) توسط Evans و مدل پتانسیل (Corrosion potential model) توسط Wagner و Traud به وجود آمد . این دو مدل به تئوری مدرن الکتروشیمیایی پیوستند که خوردگی فلزت را به عنوان دو واکنش الکتروشیمیایی اکسیداسیون آندی فلز و کاهش اکسیدانت کاتدی توصیف می کرد .
تئوری الکتروشیمیایی نه تنها برای خوردگی مرطوب فلزات در دمای معمولی کاربرد دارد بلکه برای اکسیداسیون خشک فلزات در دمای بالانیز می توان به کار برد .
مواد فلزی در شرایط مختلف محیط های گازی و آبی خورده می شوند . در ادامه به معمولترین شرایط خواهیم پرداخت :
مکانیزم عمل
فرآیند پایه خوردگی فلزی در محلول آبی شامل اکسیداسیون آندی فلزات و کاهش (احیا)کاتدی اکسیدانت (اکسید کننده) موجود در محلول است :
MM → M2+ aq + 2e− anodic oxidation
2Oxaq + 2eM− → 2Red(e− redox)aq cathodic oxidation
در فرمول MM فلز را در حالت پیوند فلزی نشان می دهد ، M2+aq یون هیدراته فلزی در محلول آبی است ، e-M الکترون فلزی است ، Oxaq اکسیدانت می باشد ، Red(e-redox)aq یک کاهش دهنده را نشان داده و e-redox الکترون کاهش را در کاهش دهنده نشان می دهد .
واکنش کلی خوردگی فلزات را می توان به شکل زیر نشان داد :
MM + 2Oxaq → M2+ aq + 2Red(e− redox)aq
روی و هیدروکلریک اسید
به عنوان مثال فلز روی در تماس با اسید کلریدریک دچار خوردگی شده و ZnCl2 و H2 تشکیل می شوند :
اکسیداسیون ( واکنش آندی) Zn → Zn2+ + H2
احیا (واکنش کاتدی) 2H+ + 2e- → H2
واکنش نهایی : Zn + 2HCl → ZnCl2 + H2
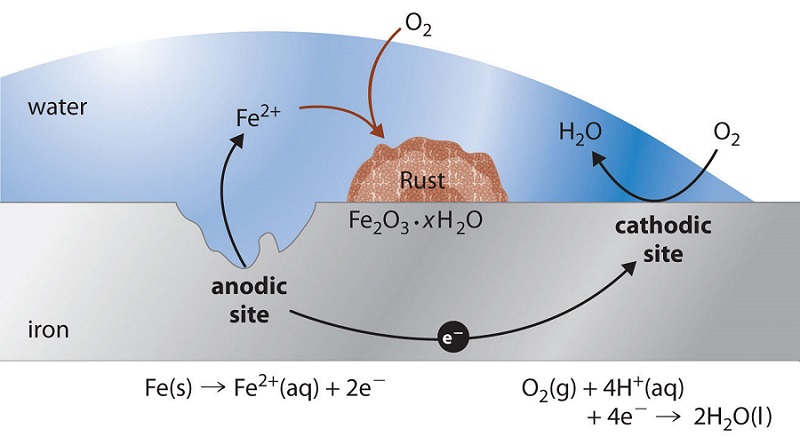
همانگونه که در واکنش بالا می توان مشاهده کرد ، فلز روی به روی کلرید تبدیل شد که یک ترکیب کاملا متفاوت با روی است و بر روی سطح فلز قرار می گیرد . مثال دیگر زنگ آهن است ، آهن در اثر خوردگی اکسید شده و لایه ای تقریبا قرمز رنگ و بسیار سست تر نسبت به آهن بر روی آن قرار می گیرد ، که باعث تخریب و از دادن رفتن شکل اولیه آهن می گردد .
این واکنش ها فرآیندهای انتقال بار هستند که در سطح تماس فلز و محلول آبی رخ می دهند، بنابراین به پتانسیل سطحی وابسته هستند که دقیقا مطابق است با آنچه که در الکتروشیمی به عنوان پتانسیل الکترودی فلزات شناخته می شود . در فیزیک پتانسیل الکترود سطح انرژی الکترون ها را در یک الکترود غوطه ور در الکترولیت بیان می کند .
در ادامه به تعریف چند مورد از اصطلاحات تخصصی به کار گرفته شده در متن خواهیم پرداخت :
تعاریف
الکترولیت :
1: سیالی که توانایی عبور جریان الکتریکی را دارد . 2: ماده ای که وقتی در محلولی حل شود به صورت یون در بیاید (به عنوان مثال نمک طعام هنگامی که در آب حل شود به یون های سدیم و کلر تجزیه می شود ، این یون ها به محلول توانایی انتقال الکتریسیته را می دهند) .
نکته : فلزات مایع الکترولیت نیستند زیرا انتقال الکتریسیته در آنها از طریق الکترون های آزاد صورت می گیرد .
الکترود :
هدایت کننده الکترونیکی که در تماس با یک هدایت کننده یونی قرار دارد . یک هادی که الکترون ها را بیرون یا جمع می کند . این شامل فصل مشترک بین محلول و یک فلز است که عمل انتقال بار نتیجه واکنش الکتروشیمیایی می باشد . الکترود مثبت آند و الکترود منفی کاتد نامیده می شود . انواع الکترودهایی که در الکتروشیمی به کار می روند عبارتند از :
- فلز ، یون فلزی ، مانند Cu و Cu2+
- خنثی ، یک غیرفلز در محلول یون ، نظیر Pt و I-
- الکترود خنثی ، یون های با ظرفیت های مختلف نظیر Pt ، Fe3+ و Fe2+
- الکترود خنثی ، گاز ، یون ، مانند H2 و H+
- ملقمه ، یون ، مانند (Cd + Hg) و Cd2+
- الکترود نمک غیرقابل حل یا اکسید ، یون ، نظیر Ag ، AgCl و Cl-
هر کدام از این الکترودها می توانند با هم ترکیب شده و یک پیل را تشکیل دهند . نیروی الکتروموتیوی آنها برابر با مجموع جبری پتانسیل های دو الکترود است .
پتانسیل الکترود :
به اختلاف پتانسیل تولید شده بین الکترود و محلول در یک نیمه پیل اطلاق می شود . همچنین به پتانسیل یک الکترود که در مقایسه با یک الکترود مرجع اندازه گیری می شود ، اطلاق می گردد .
انواع خوردگی
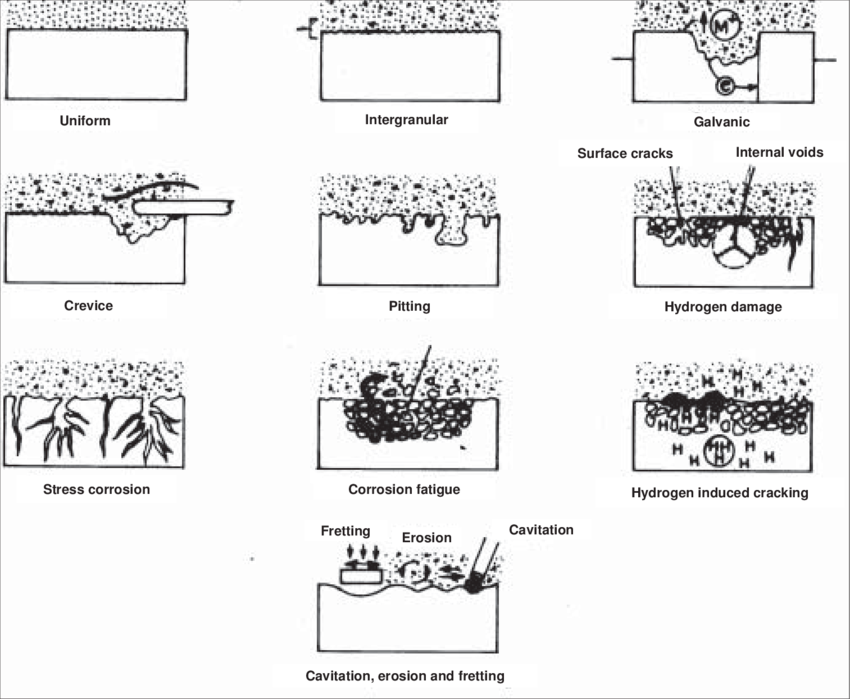
5 نوع خوردگی مهم عبارتند از : گالوانیک ، تنشی ( Stress cracking) ، کلی ، محلی و عامل سوز آور .
گالوانیک بسیار متداول است و هنگامی اتفاق می افتد که که دو فلز با بارهای متفاوت الکتروشیمیایی از طریق یک مسیر رسانا به همدیگر متصل شوند و هنگامی اتفاق می افتد که یون های فلزی از سمت فلز آندی به سمت فلز کاتدی می روند . برای کنترل این موضوع یک پوشش بر روی فلز قرار می گیرد تا از انتقال یون و یا شرایط این عمل جلوگیری کند .
خورگی تنشی ((Stress –corrosion cracking (SCC)
هنگامی که یک قسمت از یک ماده در معرض تنش شدید کششی قرار می گیرد ، باعث به وجود آمدن شکافهایی در مرز تنش می شود و این شکافها باعث به وجود آمدن نقاطی با پتانسیل زیاد برای خوردگی می شود .
خوردگی کلی (General corrosion)
این نوع در سطح کل فلز و یا مواد دیگر اتفاق می افتد . برای جلوگیری از آن می توان لایه ای محافظ را به عنوان پوشش بر روی سطح مورد نظر قرار داد .
محلی
این نوع خوردگی در قسمت کوچکی اتفاق می افتد .
عوامل سوز آور
این نوع خوردگی هنگامی اتفاق می افتد که گازهای ناخالص ، مایعات و یا جامدات خورنده با سطح مورد نظر در تماس باشند . به عنوان مثال تماس هیدروکلریک اسید با روی یا سایر فلزات . گازهای ناخالص معمولا در حالت خشک اثر چندانی ندارند اما هنگامی که رطوبت نیز موجود باشد باعث خوردگی خواهند شد . هیدروژن سولفید به عنوان یکی از عوامل سوزآور شناخته می شود .
انواع دیگری نیز وجود دارند که در شکل زیر می توان مشاهده کرد :
جلوگیری از خوردگی فلزات
یکی از راه های معمول برای انجام این کار استفاده از یک پوشش بر روی سطح مورد نظر است . پوشش ضد خوردگی فلزات به عوامل مختلفی همچون نوع فلزات درگیر و نوع جلوگیری مورد نیاز ، بستگی دارد .
برای جلوگیری از خوردگی گالوانیکی در آهن و آلیاژهای فولادی ، پوشش های ساخته شده از روی و آلومینیوم در شرایط محیطی مناسب هستند .
در سازه های بزرگ مانند پل ها و توربین های بادی از پوشش روی و آلومینیوم استفاده می شود زیرا این پوشش محافظت طولانی مدت را تامین می کند .
بست ها و پیچ های ساخته شده از آهن و فولاد معمولا با یک لایه نازک از کادمیوم پوشش داده می شوند ، که به جلوگیری از جذب هیدروژن کمک می کند . جذب هیدروژن می تواند به ترک تنشی منجر شود .
علاوه بر پوشش های روی ، کادمیوم و آلومینیوم معمولا پوشش های نیکل- کروم و کبالت – کروم نیز به دلیل تخلخل پایینی که دارند برای جلوگیری از خوردگی مورد استفاده قرار می گیرند . این ترکیبات از مقاومت بالایی در برابر رطوبت برخوردار بوده و از تشکیل زنگ و تخریب فلز جلوگیری می کنند . اکسید سرامیک ها و مخلوط های فلز-سرامیک از جمله پوشش هایی هستند که هم در برابر نفوذ و هم در برابر corrosion بسیار مقاوم هستند .
علاوه بر پوشش های فیزیکی از مواد شیمیایی ضد خوردگی نیز می توان بهره برد .
خوردگی فلزات در صنعت نفت
نفت خام موجود در مخازن همواره دارای مقادیری آب و ناخالصی است . این آب عموما محلولی از آب و نمک است و به صورت امولسیون ( آب در نفت یا نفت در آب) پایدار است که در صورت تماس با فلزات (خطوط لوله ، مته ها ، تجهیزات سرچاهی و …) می تواند باعث خوردگی آن ها شود .
همچنین نفت خام علاوه بر ترکیبات هیدروکربنی می تواند حاوی ترکیباتی مانند گوگرد ، نیتروژن ، اکسیژن و فلزات باشد . میکروارگانیسم ها نیز از دیگر ناخالصی هایی هستند که میزانشان بسته به نوع نفت متفاوت است و بر روی خوردگی نفت خام اثر می گذارند .
خورندگی نفت خام
ترکیب نفت خام بسیار پیچیده بوده و فاکتورهای بسیاری بر روی خورندگی آن اثر می گذارند که در عمل پیش بینی میزان خورندگی را بر اساس ترکیب فیزیکی و شیمیایی غیر ممکن می کند . عموما خورندگی نفت را بر اساس عدد اسیدی کل (TAN) ، میزان گوگرد کل ، میزان آب و نمک و مقدار میکروارگانیسم ها می سنجند . مقدار این پارامترها و عوامل دیگری مانند نحوه استخراج ، نحوه حمل و نقل و نگهداری و … همگی بر روی میزان خوردگی تاثیر می گذارند .
البته آگاهی از مقدار TAN و محتوای کل گوگرد نیز نمیتواند سنجش میزان خورندگی را دقیقا در اختیار ما بگذارد ، به عنوان مثال H2S و آلکانتیول ها نسبت به فولاد خورنده هستند در حالیکه تیوفن ها خورنده نیستند . تنها راه دقیق برای سنجش خورندگی یک نفت خام اندازه گیری تجربی آن است .
بازدارنده های خوردگی
بازدارنده ها (inhibitor) موادی هستند که برای جلوگیری از رسیدن آسیب به مواد به فرایند اضافه می شوند . این مواد یا تشکیل یک لایه نازک بر روی فلز و یا تجهیزات از آن محافطت می کنند . بازدارنده ها از وقوع خوردگی جلوگیری می کنند اما خوردگی هایی که از قبل به وجود آمده است را نمی توانند از بین ببرند . بر اساس مکانیزم عمل ، بازدارنده ها را می توان به سه دسته ، آنیونی ، کاتیونی و مخلوط آنیونی و کاتیونی تقسیم بندی کرد . کارایی این بازدارنده ها به pH محیط بسیار وابسته است .
بر اساس ماهیت شیمیایی ، بازدارنده های خوردگی را می توان در گروه های زیر دسته بندی کرد :
- آمین ها و نمک های آمونیوم
- ایمیدازولین
- نمک های چهارتایی آمونیوم
- ترکیبات هتروسیکلیک که دارای یک اتم نیتروژن هستند .
برخی از بازدارنده های معمول که در صنعت نفت و گاز مورد استفاده قرار می گیرند عبارتند از :
- تولیل تری آزول
- بنزوتریازول
- بنزالکونیوم کلراید
- رودانین
خوردگی در محیط های مختلف
محیط هایی که خوردگی فلزات در آنها اتفاق می افتند را به سه بخش تقسیم کرده اند که عبارتند از : محیط آبی ، گازی ، نمک های مذاب و فلزات مایع . نمک های مذاب و فلزات مایع بیشتر در صنایع هسته ای اهمیت دارد از این رو به محیط های آبی و گازی می پردازیم.
محلول ها یا محیط های آبی
علاوه بر هوای اتمسفر که عمومی ترین محیط شناخته شده است ، محلول های آبی شامل آب خنثی، رطوبت موجود در اتمسفر، باران و نیز محلول هایی که ساخته دست انسان هستند، به عنوان محیط های مرتبط با پدیده خوردگی آبی مطرح می باشند. به خاطر وجود هدایت یونی در این نوع محیط ها، خوردگی در اثر واکنش های الکتروشیمیایی اتفاق می افتد. این نوع خوردگی به شدت تحت تاثیر عواملی نظیر پتانسیل الکترود و اسیدیته محلول است. تعادل واکنش های الکتروشیمیایی توسط پارامترهای ترمودینامیکی تعیین می شود به صورتی که در صورت انحراف از حالت تعادل ، جهت و نیروی رانش قابل محاسبه می باشد.
قوانین سینتیکی واکنش ها اصولا با انرژی های اکتیواسیون فرآیندهای الکترود، انتقال جرم و خواص اصلی فصل مشترک فلز-محیط (مانند مقاومت لایه های سطحی) مرتبط هستند. سرعت واقعی خوردگی تحت تاثیر متغیرهای محیطی و متالورژیکی است . تلبته شرایط خاصی در طبیعت و نیز در سیستم های صنعتی وجود داردکه ارگانیسم های بیولوژیکی که در محیط حضور دارند، خودشان را به سطح سازه می چسپانند. حضور این موجودات می تواند سبب وقوع خوردگی شود. لایه های میکروبی ، محصولات تولید شده از سوخت و ساز این ارگانیسم ها هستند.
محیط گازی
در این نوع خوردگی محیط به صورت نارسانا بوده و فرآیندهای یونی ، به سطح فلز و لایه های محصول محدود می شوند. چون سرعت واکنش فلزات صنعتی با گازهای متداول در دمای اتاق پایین است، خوردگی گازی عموما تخت عنوان اکسیداسیون شناخته می شود.
خوردگی گازی تنها در دماهای بالا که فرآیندهای نفوذی غالب هستند به عنوان مشکلی صنعتی مطرح می باشد . عوامل ترمودینامیکی ، نیروی رانش حرکت واکنش ها را تعیین کرده و نمودارهای انرژی – دما عموما برای نشان دادن تعادل در سیستم های ساده به کار می روند. حالت تعادل در محیط های پیچیده تر را به عنوان تابعی از تغییرات ترکیب و با استفاده از نمودارهای پایداری همدما می توان تعیین کرد.
در مورد مکانیزم و سینتیک اکسیداسیون، نسبت حجمی اکسید به فلز به عنوان شاخصی از احتمال تشکیل لایه محافظ به کار می رود ولی نقش اصلی متعلق به ئفرآیندهای هدایت و انتقال است که به شدت تحت تاثیر ناخالصی ها و ساختارهای معیوب ترکیبات می باشد. سرعت های واکنش به طور معمول از طریق چند قانون سرعت سینتیک (مانند خطی، لگاریتمی و سهمی) بیان می شوند، همراه با شرایط پایداری لایه سطحی ، توسط فرآیندهای انتقال تعیین می گردند.
آشکارترین نتیجه اکسیداسیون در دماهای بالا، تشکیل پوسته اکسیدی است. میزان حفاظت این پوسته ها توسط خواص آنها و توسعه تنش ها تعیین می شود. در برخی از حالات اکسیداسیون فلزات، واکنش ها در درون سازه فلزی اتفاق افتاده و تحت عنوان “اکسیداسیون داخلی” مطرح می شوند. اکسیداسیون انتخابی یا ترجیحی شبیه فرآیند خوردگی در مایعات ، غالبا در آلیاژهایی که شامل عناصر و ترکیباتی با پایداری ترمودینامیکی متفاوت هستند، مشاهده می شود.
منابع
Sato, N. (2012). Basics of corrosion chemistry. Jonh Wiley & Sons, New York.
Brzeszcz, J., & Turkiewicz, A. (2015). Corrosion inhibitors–application in oil industry. Nafta-Gaz, 71(2), 67-75.
محصولات ضد خوردگی: