توضیحات
استات سدیم خشک چیست؟ این ماده برای جلوگیری از رشد باکتری ها به مواد غذایی اضافه می شود و نقش نگهدارنده دارد. این ماده به صورت خشک و هیدراته در بازار موجود می باشد. محصول فوق کاربرد های دیگری در تهیه و تولید پارچه، رنگدانه و… نیز دارد. استفاده از این ماده در محیطهای صنعتی و آزمایشگاه می تواند عوارض و مضراتی نیز داشته باشد. شما می توانید برای ثبت سفارش خرید و یا استعلام قیمت فروش استات سدیم با مشاوران ما از روش های زیر در ارتباط باشید.
خرید استات سدیم:
برای خرید این محصول در انواع خشک و هیدراته تنها کافیست با کارشناسان واحد فروش مجموعه ما در تماس باشید.
فروش استات سدیم صنعتی :
مبتکران شیمی یکی از تامین کنندگان مواد شیمیایی آماده فروش این محصول با تضمین کیفیت و ارائه آنالیز اختصاصی به مشتریان عزیز می باشد.
قیمت استات سدیم چینی:
استعلام قیمت لحظه ای این محصول و سایر مواد شیمیایی مورد نیازتان را از ما بخواهید.
استات سدیم چیست؟
استات سدیم (sodium acetate) با فرمول شیمیایی C2H3NaO2 به راحتی در آب حل می شود. استات سدیم صورت جامد کریستالی سفید تا کرم رنگ با بوی شبیه به سرکه است. به عنوان افزودنی غذایی عوارض جانبی ندارد. این ماده به عنوان عامل قلیایی کننده در پزشکی، افزودنی در صنایع غذایی، لوازم آرایشی و بهداشتی و آزمایشگاهی کاربرد دارد.
خواص و ویژگی ها
| ساختار | 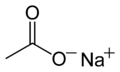 |
| فرمول شیمیایی | C2H3NaO2 |
| جرم مولی | 82.03 g/mol |
| حلالیت | به خوبی در آب، الکل، هیدرازین و دی اکسید گوگرد حل می شود. |
| چگالی | 1.528gr/cm3 |
| بو | بوی سرکه |
| دمای ذوب | 324 °C |
| دمای جوش | 881.4 °C |
| شکل ظاهری | جامد کریستالی سفید- کرم رنگ |
محصول فوق نمک سدیم استیک اسید است و جزو نمک های ارگانیک سدیم به حساب می آید. فرمول شیمیایی آن به صورت C2H3NaO2 است. جامدی است سفید رنگ به صورت پودر گرانوله، جاذب رطوبت است، بو ندارد، در 328°C ذوب می شود، در آب به خوبی حل می شود و در الکل به آرامی حل می شود.
این ماده و سایر بی کربنات ها به عنوان عوامل قلیایی کردن مورد استفاده قرار می گیرند و این امر در پزشکی بسیار مورد استفاده قرار می گیرد. در کبد، این ترکیب به بی کربنات متابولیزه می شود. برای انجام این کار ابتدا استات به آرامی به کربن دی اکسید و آب هیدرولیز میشود که پس از اضافه شدن یون هیدروژن به این دو بی کربنات حاصل می شود. این ماده در بدن به عنوان منبع یون سدیم عمل می کند.
سدیم نقش مهمی در تنظیم حجم مایع خارج سلولی دارد. توزیع آب در بدن را کنترل می کند، فشار اسمزی و تعادل الکترولیتی مایعات بدن را نیز برقرار می کند. در صنایع غذایی نیز از این ماده به عنوان عامل طعم دهنده استفاده می شود.
طرز تهیه و روش تولید :
ساده ترین راه برای تولید این ماده خنثی سازی استیک اسید با کربنات سدیم است، پس از خشک کردن محلول بدست آمده و خارج کردن آب آن، کریستال های این ماده برجای می مانند. این واکنش به صورت زیر انجام می گیرد:
NaHCO3 + CH3COOH —> CH3COONa + CO2 + H2O
روش دیگر برای تولید محصول فوق واکنش استیک اسید با قلیا هایی مانند کاستیک سودا است.
کاربردهای استات سدیم خشک:
چند نمونه از کاربرد های دیگر این ماده به شرح زیر هستند:
افزودنی به مواد غذایی
این ماده در صنایع غذایی دارای گرید E262 می باشد.
ترکیب فوق به عنوان یک اسید نقش خنثی کردن قلیا در غذا را دارد و در برخی موارد از آن برای تنظیم سطح pH استفاده می کنند. سدیم نیز به عنوان طعم دهنده مورد استفاده قرار گیرد. بر خلاف بسیاری دیگر از افزودنی ها این ماده تاثیر مضری بر بدن انسان ندارد بنابراین با توجه به گسترش استفاده از محصولات غذایی با ماندگاری بالا تقاضا برای خرید استات سدیم خشک و آبدار توسط تولید کنندگان این محصولات افزایش یافته است.
این ماده می تواند از رشد باکتری ها جلوگیری نماید و نگهدارنده ای مناسب برای محصولات غذایی باشد
چرا مواد غذایی به نگهدارنده نیاز دارند؟
به دلایل زیر در محصولات غذایی از نگهدارنده ها استفاده می شود:
- آنزیم ها:
به طور طبیعی آنزیم های موجود در گوشت ، ماهی و طیور بعد از کشته شدن نیز همچنان رشد می یابند. رشد این آنزیم ها را می توان با استفاده از نگهدارنده ها، گرم کردن، سرد کردن، کنسرو سازی ، استفاده از نمک و نگهدارنده ها متوقف نمود. در صورتی که رشد این آنزیم ها متوقف نشود این مواد می توانند سبب نابودی بافت مواد غذایی، تغییر رنگ و مزه ی آن ها شود.
- اکسیژن:
اکسیژن موجود در هوا می تواند تاثیر نامطلوبی بر روی مواد غذایی داشته باشدو چربی ها را اکسید و سفت می کند ، رنگ مواد غذایی را قهوه ای می کند و بر مواد مغذی از جمله ویتامین ها تأثیر منفی می گذارد. در نتیجه برای عدم نفوذ اکسیژن به مواد غذایی استفاده از بسته بندی مناسب اهمیت ویژه ای دارد.
- میکروارگانیسم ها:
میکروارگانیسم ها به حدی کوچک هستند که نمی توانند با چشم دیده شوند. سه نوع از میکروارگانیسم ها ( باکتری ها ، کپک ها و مخمرها ) از جمله متداول ترین میکروارگانیسم ها می باشند که می تواند موجب فساد و خرابی غذا ها شوند. وجود این میکروارگانیسم ها به حدی برای سلامتی مضر است که برخی از آن ها حتی می توانند مسمومیت ها و یا حتی مرگ ناشی از مواد غذایی آلوده به آن ها را به همراه داشته باشند. بسیاری از این میکروارگانیسم ها از جمله باکتری های اسپورفورماتیک که کشتن آنها دشوار است ، در خاک و گیاهان یافت می شوند. فلس ، پوست و پر حیوانات منشا بسیاری از میکروارگانیسم ها می باشد .
همچنین بسیاری از باکتریها از جمله عوامل بیماری زایی مانند کامپیلوباکتر ، سالمونلا ، اشرشیاکلی نیز در روده حیوانات یافت می شوند. در صورتی که شرایط محیطی فراهم باشد این میکروارگانیسم ها به شدت رشد می یابند. با محدود نمودن فعالیت میکروارگانیسم ها با تغییر pH می توان مانع از رشد این میکروارگانیسم ها شد.
به عنوان مثال اسپویل ها و باکتری های مضر در دامنه ی pH بین 4.6 تا 7 فعالیت می نمایند.کاهش pH با تخمیر مواد غذایی یا اضافه کردن اسید (مانند ساخت ترشی) و برخی نگهدارنده ها به آن ها باعث کاهش رشد این باکتری ها می شود.
-
چه مواد غذایی حاوی این ماده شیمیایی می باشند؟
در چیپس های نمکی و سرکه ای از این ترکیب استفاده می شود.
تولید کنندگان در ساخت پنیر های فراوری شده، خامه ترش، ماست از خاصیت امولسیون کنندگی و نگهدارندگی این ترکیب استفاده می نمایند
کنسرو ها و میوه های خشک برای جلوگیری از رشد باکتری ها و حفظ خواص محصول از این ماده استفاده می نمایند
برای حفظ ماندگاری آجیل ها ، حبوبات و کره ی بادام زمین نیز این ترکیب کاربرد زیادی دارد
کنسرو های گوشت نیز از این ماده برای افزایش ماندگاری استفاده می کنند. در کنسرو های ماهی مانند ساردین و یا صدف های تخمیر شده نیز از استات سدیم برای افزایش ماندگاری استفاده می شود
این ماده به دلیل آنکه امولسیفایر خوبی است در بستنی ها به وفور استفاده می شود. علاوه بر این استفاده از این ترکیب در محصولاتی مانند شکلات ، آب نبات و بستنی ، شربت ، سس کچاپ و خردل سبب افزایش ماندگاری و بهبود خواص امولسیفایری این محصولات می شود.
استفاده آزمایشگاهی
این ماده یک ماده رایج مورد استفاده در آزمایشگاه های زیست شناسی مولکولی و بیوشیمی است. یکی از کاربردهای آن خارج کردن DNA از سلول است.
کاربرد در صنعت
برای خنثی کردن اسید سولفوریک موجود در جریان های دورریز مورد استفاده قرار می گیرد. در فرآیندهای خاص عکاسی برای پوشش دادن یک شکل مشخص بر روی سطوح استفاده می شود. در سطوح فلزی می تواند به از بین رفتن ناخالصی ها از روی سطح آن کمک کند.
کیسه حرارتی
پد ها یا کیسه های حرارتی که در داروخانه ها موجود هستند شامل این ماده به صورت فوق اشباع هستند. در این پدها یک دیسک مسطح فلزی در داخل کیسه قرار دارد، با ضربه زدن به دیسک کریستال های این ماده چسپیده به سطح دیسک از آن جدا شده و با ورود به محلول فوق اشباع به صورت زنجیر های موجب تشکیل کریستال های بیشتر می گردند.
گرمای حاصل از تشکیل کریستالها موجب گرم شدن محلول موجود در داخل کیسه می شوند.
این پدها قابلیت استفاده مجدد را نیز دارند. با خیساندن پد در آب جوش و قرار دادن آن در معرض هوای اتاق محلول فوق اشباع این ماده دوباره تشکیل می گردد. در طی این فرآیند مقداری از کریستالها بر روی لبه دیسک فلزی باقی میمانند که برای استفاده دوباره از پد لازم هستند.
در صنعت گرید های متفاوتی از نوع خشک این ماده تولید می شود. غلظت 99% بدون آب، برای مصارف عکاسی تولید می شود. گرید عکاسی دارای محدوده کوچک توزیع اندازه ذرات و همچنین تراکم و یکنواختی ذرات نیز بیشتر است. غلظت 60% در صنایع شیمیایی و غذایی کاربرد دارد. گرید های دیگری نیز با غلطت 40% و 33% نیز از این ماده تولید می شوند.
این ماده قابل احتراق است، و در تماس با حرارت و اسیدهای قوی تجزیه می شود.
بهترین قیمت خرید استات سدیم تنها در مبتکران شیمی
محصولات آرایشی
این ترکیب به عنوان نگهدارنده در محصولات آرایشی با دامنه ی پی اچ بالا معمولا مورد استفاده قرار می گیرد. علاوه بر این ، به دلیل خاصیت بافری که این ترکیب از خود نشان می دهد از آن در رنگ مو ها، شامپو ها و محصولات مراقبت شخصی مانند دئودرانت ها استفاده می شود.
تهیه بافر
از بافر این ماده برای خالص سازی و رسوب دهی اسیدهای نوکلئیک و همچنین تبلور پروتئین ها استفاده می شود. این ماده در هماتولوژی بسیار محبوب می باشد زیرا تحقیقات نشان می دهد که تزریق این ترکیب سبب افزایش پایداری نمونه ها می گردد.
بافر استات ارزان قیمت است و تهیه آن آسان می باشد همچنین این ماده می تواند در دمای اتاق نگهداری شود.
برای تهیه ی 1 لیتر بافر استات با پی اچ 3.6 تا 5.6 به موارد زیر نیاز است:
| ترکیبات | جرم | مولاریته |
| استات سدیم خشک (mw: 82.03 g/mol) | 7.721 g | 0.0941 M |
| اسید استیک (mw: 60.05 g/mol) | 0.353 g | 0.0059 M |
800 میلی لیتر آب مقطر را درون یک ظرف بریزید. سپس 7.721 گرم از استات را به آن بیافزایید. سپس 0.353 گرم استیک اسید را به محلول اضافه نمایید.با استفاده از HCl یا NaOH محلول را به pH مورد برسانید. در نهایت به محلول ساخته شده آب مقطر اضافه کنید تا به حجم یک لیتر برسد.
مراحل تهیه استات سدیم خشک:
- ابتدا مقدار 500 cc سرکه (سرکه حاوی 3 تا 7 درصد استیک اسید است) را در یک ظرف بریزید.
- مقدار 35 گرم (7 قاشق غذا خوری) جوش شیرین (بی کربنات سدیم) را به آن اضافه کنید.
- در هنگام اضافه کردن جوش شیرین به سرکه حباب های کربن دی اکسید تولید و از محلول خارج می شوند، جهت جلوگیری از سرریز شدن محلول با یک قاشق یا میله فلزی زبر محلول را هم بزنید.
- محلول مایع حاصل از این اختلاط را به ظرفی دیگر جهت جوشاندن انتقال دهید. جامد باقیمانده در ظرف جوش شیرین است که نباید به ظرف جوشش وارد شود.
- محلول را به آرامی و با حرارت کم گرم کنید به صورتی که بتوانید سطح آن را مشاهده کنید. هنگام مشاهده اولین ذرات جامد تشکیل شده، محلول را فورا از روی حرارت بردارید.
- با سرد شدن محلول، این ماده حل شده در آب به صورت کریستال از آن جدا می شود. در حدود یک ساعت و نیم زمان لازم است تا کریستال ها مشاهده شوند. پس از تشکیل کریستال ها آب اضافی را دور بریزید.
بررسی بازار جهانی خرید و فروش استات سدیم :

عمده میزان خرید استات سدیم خشک مربوط به صنایع چرم و نساجی می باشد، دلیل آن نیز استفاده گسترده به عنوان نمک شستشو در این صنایع (چرم) می باشد. این ماده به دلیل تثبیت و افزایش رنگ پذیری چرم، از بین بردن الکتریسیته ساکن و محافظت آن از نور خورشید کاربرد وسیعی در این صنعت دارد.
افزایش استفاده از نگه دارنده ها در صنایع غذایی و کاربرد مستقیم این ماده به عنوان نگهدارنده نیز سبب درخواست بالای مصرف این ماده در صنایع مذکور گردیده به طوریکه در سال 2016 ارزش بازار این ماده در صنایع غذایی بالغ بر 26 میلیون دلار بوده است .
به طور متوسط 60 درصد از بازار فروش استات سدیم شامل کشورهای آسیا و اقیانوسیه، 20 درصد آمریکای شمالی و 18 درصد کشورهای اروپایی می باشند، البته بر خلاف گسترش بازار مصرف این ماده در آسیا، به دلیل امکان اعمال محدودیت در مصرف نگه دارنده های غذایی در کشورهای اروپایی و اعمال مقررات بهداشتی سختگیرانه، میزان مصرف این ماده در این کشورها رو به کاهش خواهد رفت.
مضرات و عوارض :
با توجه به اینکه استات سدیم به عنوان افزودنی غذا استفاده می شود، برای سلامتی انسان مضر شناخته نشده است.
اما همواره لازم است پیش از کار کردن با مواد شیمیایی از جمله این ترکیب شیمیایی، حتما msds آن را برای آگاهی از خطرات احتمالی و اقدامات ایمنی در صورت بروز حادثه مطالعه کنید.
خطرات تماس :
- استنشاق :
استنشاق این محصول ممکن است باعث سختی در تنفس و تنگی نفس گردد که در صورت مشاهده علائم ذکر شده باید خود را به محیطی با هوای تازه رساند، درصورت تداوم تنگی نفس نیاز به اقدامات پزشکی و کپسول اکسیژن وجود دارد.
- تماس با پوست :
در صورت تماس با پوست ، مقدار اضافی ماده را از روی پوست پاک کرده و سپس محل تماس را با آب زیاد شستشو دهید.در صورت بروز علائم سوزش و التهاب مراجعه به پزشک توصیه می شود.
- بلعیدن :
اگر به طور اتفاقی این ترکیب بلعیده شد لازم است از خوردن هرگونه مایعات خودداری گردد ، دهان را با آب شستشو و به پرشک مراجعه شود.
- تماس با چشم :
تماس این ماده با چشم سبب قرمزی و سوزش می گردد بنابراین در صورت تماس، چشم را با آب فراوان شستشو دهید به طوریکه آب به همراه ماده شیمیایی از چشم خارج شود. مراجعه به پزشک ضروری می باشد.
حمل و نگهداری
این ماده در شرایط محیطی پایدار است، اما در صورت وجود رطوبت و آب، اسیدها و اکسید کننده های قوی تجزیه می شود.
سوالات متداول
تجزیه حرارتی استات سدیم چه موادی تولید می کند؟
قرار دادن این ماده شیمیایی به همراه سودا (NaOH+CaO) در معرض حرارت باعث واکنش دی کربوکسیلاسیون ( واکنش کلی در تولید آلکان ها ) و تولید کربنات سدیم و آزاد شدن متان می شود.
کاربرد استات سدیم در پزشکی چیست؟
از آن به عنوان یک مکمل الکترولیت در تزریق وریدی استفاده می شود،برای تنظیم میزان سدیم در بیماران مبتلا به هیپوناتریمی و همچنین قلیایی سازی ادرار در برخی آزمایشات به کار می رود.
آیا استات سدیم در آب حل می شود؟
بله این ماده در آب محلول است و انحلال پذیری آن با بالا رفتن دما نیز بیشتر می شود. به عنوان مثال ، در دمای 0 درجه سانتیگراد ، انحلال پذیری نوع بدون آب این ترکیب در آب 1190 گرم در لیتر است. این در حالی است که اگر درجه حرارت به 100 درجه سانتیگراد افزایش یابد ، حلالیت این ترکیب در آب به 1629 گرم در لیتر افزایش می یابد
یخ داغ چیست ؟
یخ داغ یا Hot Ice در واقع همان بلورهای استات سدیم است که به راحتی قابل تهیه می باشد به این صورت که سرکه به آرامی به جوش شیرین افروده شده و دراثر واکنش این دو، محصول مورد نظر تولید و گاز دی اکسید کربن نیز آزاد می شود، در نهایت محلول حاصل جوشانده شده تا تغلیظ شود و بعد از رسیدن به غلظت مناسب آن را سرد می کنند که این امر موجب تشکیل بلورهای استات سدیم (شبیه بلورهای یخ ) می شود، افزودن این بلورها به آب سبب آزاد شدن گرما می گردد که به همین دلیل به آن یخ گرم یا یخ داغ نیز گفته می شود.
جهت خرید استات سدیم با ما در مبتکران شیمی در تماس باشید.

















نقد و بررسیها
هنوز بررسیای ثبت نشده است.