توضیحات
سدیم هیدروکسید (Sodium Hydroxide) ترکیبی با فرمول شیمیایی NaOH یک باز بسیار قوی است و به دلیل خواص فیزیکی و شیمیایی منحصر به فردی که دارد در تعداد بسیار زیادی از صنایع مورد استفاده قرار می گیرد. دو شکل رایج این ماده به صورت مایع و جامد (عموما به صورت پرک و گرانول) هستند که شکل مایع آن محلول در آب و فرم جامد آن دارای خلوص بالایی می باشد. شما می توانید جهت ثبت سفارش و اطلاع از نحوه فروش و قیمت خرید سدیم هیدروکسید با مشاوران ما در ارتباط باشید. در ادامه متن با خواص ، کاربردها ، روش تولید و واکنش های این باز قوی آشنا خواهیم شد.
خرید سدیم هیدروکسید
برای برخی این سوال مطرح است که “هیدروکسید سدیم را از کجا بخرم؟” مبتکران شیمی این محصول را با کیفیت و قیمت ویژه به صورت عمده در اختیار مصرف کنندگان عزیر قرار می دهد.
قیمت سدیم هیدروکسید
با توجه به تغییرات دائمی و روزانه وضعیت بازار مواد شیمیایی و به تبع آن تغییرات قیمت، کارشناسان ما قیمت های به روز را به شما اعلام می کنند. جهت استعلام قیمت با شماره های موجود در بخش تماس با ما، تماس بگیرید .
سدیم هیدروکسید چیست؟
سدیم هیدروکسید E524 با فرمول شیمیایی (NaOH) یا کاستیک سودا یا سود سوز آور، ماده ای معدنی است. این قلیای قوی در دمای اتاق به شکل جامد کریستالی و بدون بو است. از سدیم هیدروکسید برای کنترل pH و ایفای نقش بافر در تهیه بسیاری از مواد همچون محصولات آرایشی و بهداشتی استفاده می کنند. این باز در گذشته در ساخت صابون کاربرد داشته است. امروزه در فرمول ساخت بسیاری از مواد نیز وجود دارد. به عنوان ماده ای مجاز برای افزودن مستقیم به غذا ( با گرید خوراکی E524) شناخته می شود.
برخی از خواص فیزیکی و شیمیایی این ماده را در جدول زیر می توان مشاهده نمود:
فرمول شیمیایی NaOH جرم مولی 39.997 g/mol چگالی 2.13 g/cm³ دمای ذوب 318 °C حلالیت در آب ، اتانول و متانول محلول است
در ادامه قصد داریم چند مورد از واکنش های معروف این ترکیب با سایر مواد به همراه روش های تولید و … را مورد بررسی قرار دهیم. پس با خواندن این متن ما را همراهی کنید تا با این محصول پر کاربرد بیشتر آشنا شوید:
هیدروکسید سدیم اسید است یا باز؟
در علم شیمی مواد را می توان به سه دسته بازی، اسیدی و خنثی تقسیم بندی کرد. روش های مختلفی نیز برای دسته بندی اسیدها و بازها وجود دارد که البته برای بررسی بازی و یا اسیدی بودن سود سوزآور نیازی به دانستن همه آنها نیست و دانستن یکی کافیست که در ادامه به آن خواهیم پرداخت.
بر اساس این مدل موادی که یون OH- در ساختار خود دارند باز هستند و موادی که دارای یون H+ هستند اسید محسوب می شوند ( این تعریف جامع و کامل نیست و بسیاری از مواد از این قاعده پیروی نمی کنند). بر اساس این تعریف کاستیک سودا ماده ای بازی با خاصیت قلیایی بالایی است. pH محلول 5% وزنی از این ترکیب حدودا برابر با 14 گزارش شده است. عدد ۱۴ نشان از خاصیت بازی بسیار زیاد این ترکیب دارد.
واکنش های NaOH با سایر مواد شیمیایی
این ترکیب شیمیایی با بسیاری از مواد شیمیایی دیگر واکنش می دهد در ادامه به برخی از آنها پرداخته ایم:
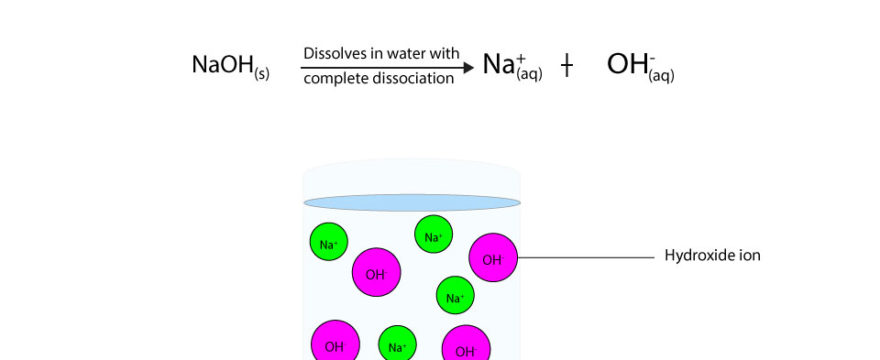
فرمول واکنش سدیم هیدروکسید با آب
هنگامی که این ماده با آب ترکیب شود در واقع واکنش شیمیایی صورت نمیگیرد و تنها عملی که انجام میگیرد تجزیه سود به یون های Na+ و OH- است. این عمل بسیار گرمازاست و در هنگام انجام آن باید مراقبت های لازم را به عمل آورد. واکنش این دو ماده به صورت زیر است.
انحلال پذیری این ماده به صورت جامد در آب و در دمای 20 درجه ی سانتی گراد حدود۱۱۱ گرم در ۱۰۰ میلی لیتر می باشد.
خرید و فروش سدیم هیدروکسید را به ما در مبتکران شیمی بسپارید
واکنش با اکسیدهای اسیدی
هیدروکسید سدیم به دو فرم جامد و محلول (مایع) وجود دارد و می تواند با بیشتر اکسیدهای اسیدی مانند سولفور دی اکسید واکنش دهد. اغلب این واکنش ها گازهای اسیدی مضر مانند SO2 و H2S تولید می کنند که از سوختن زغال سنگ تولید و باعث آزاد شدن این گازها در جو می شوند.
2NaOH + SO2 → Na2SO3 + H2O
واکنش با فلزهای آمفوتریک و اکسیدها
شیشه و محلول سود در دمای محیط به آرامی با یکدیگر واکنش میدهند تا محلول سیلیکات شکل بگیرد.
واکنش بین سیلیکات شیشه و سود تمایل به یخ زدن و یا freez شدن دارد.
NaOH با آهن وارد واکنش نمیشود زیرا آهن فلزی آمفوتر نیست و خاصیت آمفوتری ندارد
در سال 1986 تانکری آلومینیومی برای انتقال محلول کاستیک سودا 25% انتخاب شده بود. فشار ناشی از H2 تولید شده از واکنش بین هیدروکسید سدیم و آلومینیوم محتویات درون تانکر موجب آسیب رساندن به تانکر شد.
در واکنش زیر واکنش مخلوط هیدروکسید سدیم با آلومینیوم را مشاهده میکنید.
2Al + 2NaOH + 6H2O → 2NaAl(OH)4 + 3H2
گاز هیدروژن تولید شده می تواند بسیار خطرناک بوده و سبب انفجار شود. در نتیجه از نگهداری این ماده در ظروف آلومینیومی خودداری نمایید.
واکنش رسوبی
برخلاف سود ، هیدروکسید بسیاری از فلزهای واسطه نامحلول می باشد. در نتیجه از NaOH می توان به عنوان رسوب دهنده هیدروکسید فلزهای واسطه استفاده کرد. هنگام استفاده ترکیب را به صورت رنگ ها زیر مشاهده می کنیم:
آبی- مسی ، سبز-آهن(II) ، زرد/قهوه ای – آهن (III)
روی و نمک فلزی با سدیم هیدروکسید اضافه تجزیه میشوند و محلولی بی رنگ ازNa2ZnO2 و یا Na2PbO2 تولید می کنند
از هیدروکساید آلومینیوم برای تصفیه آب استفاده میکنند:
Al2(SO4)3 + 6 NaOH → 2 Al(OH)3 + 3 Na2SO4
Al2(SO4)3 + 6 NaHCO3 → 2 Al(OH)3 + 3 Na2SO4 + 6 CO2
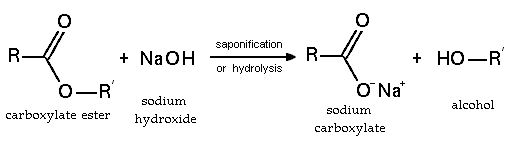
واکنش با کربوکسیلیک اسید ها
این ترکیب می تواند به راحتی با کربوکسیلیک اسید ها واکنش دهد و نمک آن ها را تولید نماید. همچنین قدرت بازی آن به قدری بالاست که می تواند با فنل ها وارد واکنش شود و موجب تولید نمک آن ها شود.
NaOH همچنین برای هیدرولیز استر ها (در طی فرایند صابون سازی) ، آمید ها و آلکیل هالید ها استفاده می شود. اما با توجه به محدودیت های موجود برای انحلال پذیری در بعضی حلال های آلی ، در بعضی از مواقع KOH به دلیل انحلال پذیری بالاتر ترجیح داده می شود.
در واکنش زیر می توانید هیدرولیز یک کربوکسیلات استر را توسط این باز قوی مشاهده نمایید:
لازم به ذکر است این ماده با اتر و سایر حلال های غیر قطبی واکنش نمی دهد.
معادله واکنش با اسید سولفوریک
این واکنش که به صورت زیر است موجب تولید سدیم سولفات و آب می شود :
2NaOH + H2SO4 → Na2SO4 + 2H2O
واکنش هیدروکسید سدیم با کات کبود
کات کبود در واکنش با سولفات مس طبق معادله زیر واکنش می دهد :
CuSO4(aq) + 2NaOH(aq) → Cu(OH)2(s) + Na2SO4(aq)
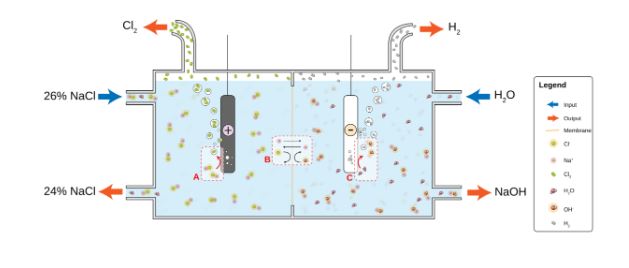
روش تولید سدیم هیدروکسید
این ماده به صورت صنعتی به عنوان محلول 50% با تغییرات فرایند الکترولیتی تولید میشود. گاز کلر معمولا در این فرایند تشکیل میشود. کاستیک سودا جامد از طریق این محلول با تبخیر آب بدست می آید. شکل ظاهری کاستیک سودا به صورت دانه ،پوسته های نازک فروخته میشود.
در سال 2004 تولید جهانی کاستیک سودای خشک 60 میلیون تن برآورده شد و تقاضا برای مصرف حدود 51 میلیون تن براورده شد. در سال 1998 تولید کل جهان 45 میلیون تن بوده است که آمریکای شکالی و آسیا هرکدام 14 میلیون تن تولید داشته اند و اروپا 10 تن تولید داشته است. از لحاظ تاریخی هیدروکسید سدیم را میتوان از تصفیه کربنات سدیم با هیدروکسید کلسیم از واکنش بدست اورد(سدیم هیدروکسید محلول است در حالیکه کربناتی کلسیمی موجود نیست) به این واکنش واکنش سوزش آور (سوختن نیز) می نامند.
(Ca(OH)2(aq) + Na2CO3(s) → CaCO3 ↓ + 2 NaOH (aq
در اواخر قرن نوزدهم فرایند solvay جایگزین این فرایند شد.
کاستیک سودا با واکنش مستقیم سدیم و آب تولید میشود که فراوردهای جانبی ان گاز و گرما هیدروژن است که اغلب موارد با شعله همراه است. جداسازی فلز سدیم با کاهش الکترولیز ترکیبات سدیمی مانند کاستیک سودا انجام میشود. محصول به دست آمده به صورت محلول در آب است و در مواردی که هدف تولید محصول با غلطت بالا باشد ، پس از انجام مراحل اضافی آن را به شکل سود پرک و یا گرانول در می آورند .
کاربرد سدیم هیدروکسید
طیف وسیعی از صنایع مختلف مصرف کنندگان سدیم هیدروکسید را تشکیل می دهند . خاصیت بازی و سفید کنندگی آن باعث شده است که در تولید مواد شوینده ، آلومینیوم ، کاغذ و …. به صورت گسترده مورد استفاده قرار گیرد . یکی از دلایلی که از محبوبیت بالاتری نسبت به بازهای دیگر دارد ، قدرت بازی بسیار بالای آن است که باعث می شود با مصرف مقدار کمتری باز در مقایسه با سایر بازها به pH مورد نظر دست یافت. در گذشته از خاکستر گیاهان برای تهیه ی صابون استفاده می گردید اما امروزه با الکترولیز نمک ها، قلیاهای گوناگونی را می سازند که از آن در تهیه ی صابون ها . سایر شوینده ها استفاده می نمایند.
در این بین KOH و NaOH دو قلیای معروف به شمار می روند که در تهیه ی شوینده های گوناگونی مورد استفاده قرار می گیرند. اگر از شوینده هایی استفاده می کنید که حاوی این ماده می باشند حتما از دستکش بلند استفاده نمایید. زیرا خطر ایجاد حساسیت و سوختگی وجود دارد.
سه کاربرد عمده ی هیدروکسید سدیم
محصولات شوینده
این ماده به دلیل قابلیت بالا در انحلال چربی ها می تواند در محصولات شوینده مورد استفاده قرار بگیرد. ترکیب فوق می تواند موجب آسیب زدن به پوست، چشم و ریه شود. در نتیجه استفاده از شوینده های حاوی این ترکیب باید با رعایت نکات ایمنی مورد استفاده قرار بگیرند. در مقیاس میکرو می تواند موجب غیر فعال سازی پروتئین ها و اسید های نوکلئیک موجود در ویروس ها و باکتری ها شود. همچنین می تواند قارچ ها، کپک ها و مخمر ها را نیز نابود سازد. همین ویژگی NaOH در از بین بردن میکروارگانیسم ها سبب کاربرد این ماده رد محصولات شوینده شده است.

صنایع دارویی
هیدروکسید سدیم در داروهایی مانند داروهای ضد انعقاد خون و حفظ کلسترول بدن در حالت نرمال مورد استفاده قرار می گیرد. همچنین به عنوان یک ماده ی غیر فعال در داروهایی از قبیل (AMRIX سیکلوبنزاپرین هیدروکلراید) ، آسپرین، دیکلوفناک سدیم، میزوپروستول، دیانانوزین ، اداربایکلر ، نکسیوم و ساوتنت و… کاربرد دارد
محصولات آرایشی و بهداشتی
در غلظت های پایین ( حدود 5 درصد) این ماده در محصولات زیر استفاده می شود:
- اسپری های مو
- عطرها
- صابون سازی
- رنگ مو
- آرایش
- محصولات مراقبت از ناخن
- شامپو
- محصولات اصلاح
در این محصولات این ترکیب می تواند موجب تثبیت pH شود. محصولات مراقبت از مو، استفاده از آن موجب می گردد تا محصول تولیدی کمتر اسیدی شود و به پوست سر آسیبی وارد نگردد. توانایی آن در مخلوط نمودن روغن نیز موجب افزایش بیشتر کارایی این ترکیب در این قبیل محصولات می شود.
خطرات سدیم هیدروکسید
این ماده را در جای خشک و خنک نگهداری نمایید. بشکه های حاوی این ترکیب بعد از خالی شدن نیز می توانند خطرناک باشند. به دلیل جذب بالای کربن دی اکسید هوا توسط این ترکیب آن را در ظروف مقاوم به هوا نگهداری می نمایند.
سدیم هیدروکسید به راحتی با چربی ها و روغن موجود بر روی پوست وارد واکنش می شود تا بتواند نمک تولید نماید. بنابراین این ماده بسیار خطرناک است و بعد از تماس با این ترکیب باید فورا محل آلوده شده را شست و شو داد. محلول های 0.5 مولار از این ماده باید با نام خورنده لیبل گذاری شوند و محلول های با غلظت 0.5–0.05 مولار می توانند منجر به حساسیت و تحریک پوست گردند.
فروش سدیم هیدروکسید
مبتکران شیمی با سال ها تجربه در زمینه تامین و تولید مواد شیمیایی آماده ارائه محصول با کیفیت بالا با بهترین قیمت به مشتریان محترم است.
سوالات متداول
آیا سدیم هیدروکسید اسید است یا باز؟
کاستیک سودا ماده ای بازی با خاصیت قلیایی بالایی است. pH محلول 5% وزنی از این ترکیب حدودا برابر با 14 گزارش شده است. عدد ۱۴ نشان از خاصیت بازی بسیار زیاد این ترکیب دارد.
آیا سدیم هیدروکسید یون است؟
این ترکیب از قرارگیری دو یون هیدروکسید و کاتیون سدیم کنار هم تشکیل می شود و یک ترکیب خنثی ایجاد می کند.
فرمول سدیم هیدروکسید چیست؟
این ترکیب که با نام سود سوزآور و کاستیک سودا نیز شناخته می شود دارای فرمول شیمیایی NaOH است.
سدیم هیدروکسید در آب چه تشکیل می دهد؟
با ریختن این ماده در آب، به یون های سازنده آن تجزیه می شود و گرما تولید می کند.














نقد و بررسیها
هنوز بررسیای ثبت نشده است.