هرآنچه که در محیط شما وجود دارد حتی خود شما از اتم ها تشکیل شده اند. ارتباط بین اتم ها و نحوه قرارگیری آن ها کنار یکدیگر، مولکول ها و ساختار هایی را تشکیل می دهد که ما می توانیم به چشم ببینیم. این ارتباطات بین اتم ها از طریق ایجاد انواع پیوندهای شیمیایی است. اتم ها همواره تمایل به رسیدن به پایداری و کمترین سطح انرژی دارند. این پایداری را با از دست دادن و یا گرفتن الکترون و همچنین از به اشتراک گذاشتن الکترون را به دست می آورند.
پیوند های شیمیایی جاذبه ای بین اتم ها، یون ها (آنیون و کاتیون) و یا مولکول ها هستند که منجر به تشکیل ترکیبات شیمیایی می شوند. انواع پیوندهای شیمیایی برحسب نوع نیروی بین مولکولی وجود دارد که شامل پیوند های یونی (مانند سدیم کلرید)، کووالانسی (مانند آمونیاک)، فلزی (مانند آلومینیوم) می باشد. قبل از بررسی انواع پیوندهای شیمیایی، بیایید کمی در مورد تئوری های موجود در تشکیل پیوندهای شیمیایی صحبت کنیم. از مهم ترین این تئوری ها، نظریه لوئیس و نظریه کوزل می باشد.
نظریات پیوندهای شیمیایی
نظریه لوئیس
- هر اتم را می توان به عنوان هسته ای با بار مثبت و پوسته خارجی در نظر گرفت.
- پوسته خارجی حداکثر هشت الکترون را در خود جای می دهد.
- هشت الکترون موجود در پوسته خارجی، گوشه های مکعبی که هسته را احاطه کرده است اشغال می کنند.
- اتم هایی که در پوسته خارجی خود هشت الکترون دارند پایدار هستند.
- اتم هایی که در پوسته خارجی خود هشت الکترون ندارند، با تشکیل پیوند شیمیایی با دیگر اتم ها و رسیدن به آرایش هشت تایی، به پایداری می رسند.
- فقط الکترون های موجود در پوسته خارجی، که به آن لایه ظرفیت نیز گفته می شود، در تشکیل پیوندهای شیمیایی مشارکت می کنند.
- به طور کلی ظرفیت هر اتم برابر با تعداد الکترون های آن در لایه ظرفیت است.
طبق نظریه لوئیس، الکترون های ظرفیت عناصر به صورت زیر با کمک نماد نقطه نشان داده می شود:

نظریه کوزل
- گازهای بی اثر، هالوژن های الکترونگاتیو و فلزات قلیایی الکتروپوزیتیو را از هم جدا می کنند.
- هالوژن ها با گرفتن الکترون آنیون و فلزات قلیایی با از دست دادن الکترون کاتیون تشکیل می دهند.
- این آنیون ها و کاتیون ها دارای آرایش هشت تایی گاز نجیب در لایه ظرفیت خود هستند. آرایش الکترونی گازهای نجیب (بی اثر)، بجز هلیوم، به صورت ns2 np6 است.
- بارهای با بار منفی توسط نیروی الکترواستاتیکی به هم جذب می شوند و کنار یکدیگر قرار می گیرند.
در سال 1916 کوزل و لوئیس نظریه ای مشترک در مورد پیوندهای شیمیایی بین اتم ها و مولکول ها ارائه دادند. اتم گازهای نجیب تمایل کمی به ترکیب با یکدیگر و یا با اتم عناصر دیگر دارند که این به علت پایداری بالای آن هاست. این ترکیبات آنقدر پایدار هستند که حتی مولکول های دو اتمی تشکیل نمی دهند و به صورت تک اتمی وجود دارند. تشکیل پیوندهای شیمیایی به علت تمایل اتم های دیگر برای رسیدن به پایداری گازهای نجیب است.
وقتی مواد شیمیایی باهم واکنش می دهند و ترکیب جدید تولید می کنند، میزان پایداری ترکیب جدید را با توجه به نوع پیوند شیمیایی موجود در آن اندازه گیری می کنند. با این توصیفات، در ادامه به بررسی انواع پیوندهای شیمیایی می پردازیم.
انواع پیوندهای شیمیایی درون مولکولی
پیوند یونی
پیوندی که بین دو اتم با بار مخالف ایجاد می شود پیوندی یونی است. یک نیروی جاذبه الکترواستاتیکی بسیار قوی است که از انتقال الکترون از یک اتم فلزی به اتمی نافلز ایجاد می شود. به عنوان مثال سدیم که در گروه یک جدول تناوبی است یک الکترون خود را از دست می دهد و به Na+ تبدیل می شود و کلرید که در گروه هفدهم جدول تناوبی است یک الکترون می گیرد و به Cl- تبدیل می شود. به علت وجود بار مثبت و منفی، دو اتم کنار هم قرار می گیرند و پیوندی بسیار قوی تشکیل می دهند.
شرایط تشکیل پیوند یونی:
- اتم تشکیل دهنده کاتیون انرژی یونیزاسیون کمی داشته باشد.
- اتم تشکیل دهنده آنیون آنتالپی بالایی برای دربافت الکترون داشته باشد.
- آنتالپی بالایی در شبکه منفی کریستال تشکیل شده داشته باشد.
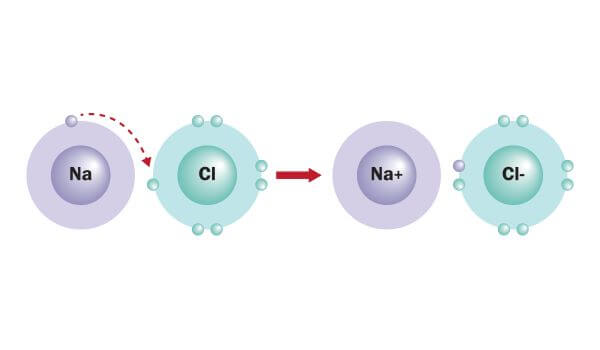
خواص و ویژگی های پیوندهای یونی
- ترکیبات یونی مذاب وقتی در میدان الکتریکی قرار می گیرند، یون هایشان آزادانه حرکت می کنند و می توانند رسانای الکتریکی باشند. اگر به صورت جامد باشند یون ها نمی توانند حرکت کنند و در نتیجه خاصیت رسانایی ندارند.
- این ترکیبات به علت نوع پیوندشان بسیار پایدار هستند و سختی بالایی دارند.
- به علت آرایش منظمی که دارند بسیار شکننده اند. به عنوان مثال نمک سدیم کلرید آرایشی شش وجهی دارد. اگر یکی از سطوح یونی آن جابجا شود، یون های با بار یکسان در مقابل هم قرار می گیرند و یکدیگر را دفع می کنند و در نتیجه بلور می شکند.
کدام گروه ها پیوند یونی تشکیل می دهند؟
فلزات موجود در گروه های یک (فلزات قلیایی)، دو (فلزات قلیایی خاکی) و سه اصلی با از دست دادن به ترتیب یک، دو و سه الکترون به آرایش گاز نجیب دوره قبل از خود می رسند. باید توجه داشت که پس از جدا شدن یک الکترون، میزان بار موثر هسته افزایش می یابد و در نتیجه جدا شدن الکترون های بعدی سخت تر اتفاق می افتد. به عنوان مثال لیتیم با از دست دادن الکترون به صورت Li+ تبدیل می شود. همچنین کلسیم با از دست دادن دو الکترون به صورت Ca2+ در می آید.
هالوژن ها که در گروه هفت اصلی قرار دارند می توانند یون هایی با بار منفی ایجاد کنند و به آرایش الکترونی گاز نجیب هم دوره خود برسند. به عنوان مثال کلر با گرفتن الکترون به Cl- تبدیل می شود. اتم های موجود در گروه شش و پنج اصلی نیز می توانند با گرفتن به ترتیب دو و سه الکترون به آرایش گاز نجیب هم دوره خود برسند و یون منفی تولید کنند.
پیوند کووالانسی
یکی دیگر از پیوندهای شیمیایی قوی بین دو یا تعداد بیشتری اتم، پیوند کووالانسی است. این پیوند زمانی تشکیل می شود که یک الکترون بین دو عنصر مشترک است. یکی از رایج ترین شکل پیوند شیمیایی در موجودات زنده است. پیوندهای کووالانسی بین عناصر تشکیل دهنده مولکول های بیولوژیکی در سلول های ما ایجاد می شود. این پیوند به طور معمول در اتم هایی با 4، 5، 6 و یا 7 الکترون ظرفیت دارند، تشکیل می شود.
در واقع در اتم های غیرفلزی تعداد الکترون ها آنقدر زیاد است که نمی توانند با گرفتن یا از دست دادن الکترون به پایداری برسند، بنابراین با اشتراک گذاری الکترون پیوند تشکیل داده و به پایداری گازهای نجیب می رسند. قدرت پیوند کووالانسی ناشی از جاذبه بین هسته مثبت یک اتم و ابر الکترونی منفی اتم دیگر است.
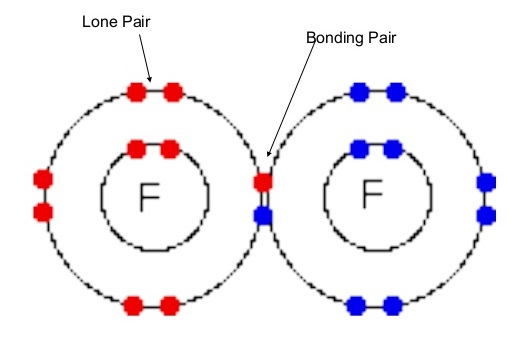
شرط لازم برای تشکیل پیوند کووالانسی بین دو اتم این است که حداقل یک اتم حاوی یک اوربیتال نیمه پر باشد. انواع پیوندهای کووالانسی شامل یگانه، دوگانه و سه گانه می باشد. این پیوندها از اشتراک جفت الکترون هایی با اسپین مخالف تشکیل شده و در نتیجه آن اوربیتال های اتمی اشغال می شود.
از جمله ترکیبات حاوی پیوند کوالانسی یگانه H2 و Cl2 می باشند. در پیوند های دو و سه گانه به ترتیب دو و سه جفت الکترون به اشتراک گذاشته می شود. معمولا می توانیم تعداد پیوندهای کووالانسی را از روی تعداد الکترون های مورد نیاز برای تکمیل لایه ظرفیت اتم ها پیش بینی کرد. در نافلرات شماره گروه با لایه ظرفیت ترکیب برابر است. طبق این موضوع می توانیم پیش بینی کنیم که اتم برای رسیدن به قاعده اوکتت چند پیوند نیاز دارد. به عنوان مثال اکسیژن در گروه ششم جدول بوده و با دو پیوند کووالانسی به پایداری می رسد.
پیوند داتیو
پیوند داتیو پیوندی است که در آن یک اتم دارای جفت الکترون ناپیوندی به الکترون دیگر با اوربیتال خالی جفت الکترون می دهد. بنابراین لازمه تشکیل پیوند داتیو این است که یکی از اتم ها در لایه ظرفیت خود دو جفت الکترون غیرپیوندی و اتم دیگر در لایه ظرفیت خود اوربیتال خالی داشته باشد. این پیوند نوعی پیوند کووالانسی محسوب می شود. به عنوان مثال آمونیاک ترکیبی است که در آن نیتروژن با سه هیدروژن پیوند کووالانسی تشکیل می دهد و به پایداری می رسد. نیتروژن در گروه پنجم قرار دارد و با اشتراک گذاری سه تا از الکترون هایش هنوز دو جفت الکترون دیگر در لایه ظرفیت خود دارد. این اتم می تواند این دو جفت الکترون را به یک اتم دیگر مانند H+ که دارای اوربیتال خالی است بدهد و پیوند داتیو تشکیل می دهد مانند آمونیوم کلراید
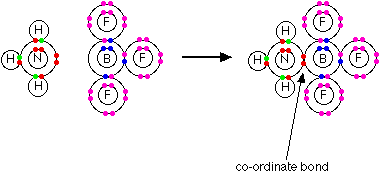
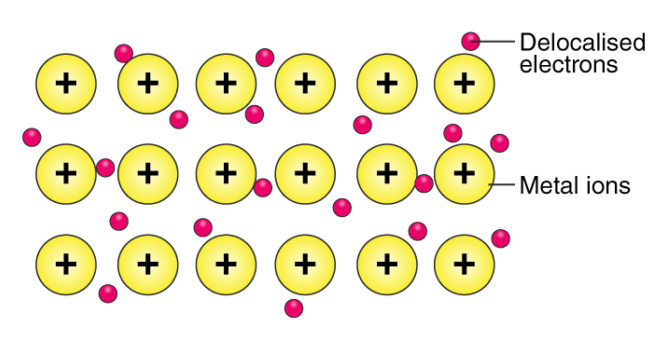
پیوند فلزی
پیوند فلزی از جاذبه میان الکترون های لایه ظرفیت و ذرات دارای بار مثبت شبکه بلور به وجود می آید. همانطور که می دانید فلزات نمی توانند پیوند کووالانسی تشکیل دهند به همین دلیل معمولا در گروه های هشت تایی قرار می گیرند و الکترون ها در میان آن ها حرکت می کنند. از جمله اینگونه فلزات می توانیم به لیتیم، سدیم و آهن اشاره کنیم. ترکیباتی با این پیوند رسانای الکتریکی و گرمایی هستند. چکش خوار و درخشندگی فلزات را نیز دارند.
انواع پیوندهای شیمیایی بین مولکولی
پیوندهای یونی و کووالانسی پیوندهای محکمی هستند که برای شکستن به انرژی قابل توجهی نیاز دارند. با این حال، همه پیوندهای بین عناصر پیوندهای یونی یا کووالانسی نیستند. پیوندهای ضعیف تری نیز وجود دارند. این پیوندها بین بارهای جزئی مثبت و منفی مود در مولکول ها ایجاد می شود و به انرژی زیاد نیاز ندارند. دو پیوند ضعیف که به طور مکرر رخ می دهد ، پیوندهای هیدروژنی و واندر والسی است. این پیوندها خصوصیات منحصر به فرد آب و ساختارهای منحصر به فرد DNA و پروتئین ها را ایجاد می کنند.
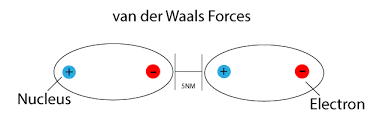
نیروهای واندوالسی
این پیوند یک نیروی بین مولکولی است. به طور کلی پیوند ضعیف بین مولکول های قطبی را واندوالس و بین مولکول های ناقطبی را نیروی پراکندگی لاندن می گویند. البته خود نیروی لاندن زیرمجموعه ای از نیروهای واندروالسی است.
زمانیکه قطب مثبت یک مولکول تا حدی به قطب منفی مولکول دیگر نزدیک باشد پیوند واندروالسی تشکیل می شود. همچنین در مولکول های ناقطبی زمانیکه پراکندگی الکترون ها برای لحظه ای غیریکنواخت شود، یک دوقطبی لحظه ای تشکیل می شود، که منجر به ایجاد نیروی لاندن می شود.
پیوند هیدروژنی
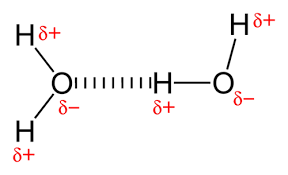
وقتی پیوندهای کووالانسی قطبی حاوی یک اتم هیدروژن تشکیل می شود، اتم هیدروژن موجود در آن پیوند جزئی بار مثبت دارد. این به این دلیل است که الکترون مشترک با شدت بیشتری به سمت عنصر دیگر جذب و از هسته هیدروژن دور می شود. از آنجا که اتم هیدروژن جزئی مثبت است (δ +)، به بارهای جزئی منفی مولکول های همسایه (δ–) جذب می شود. هنگامی که این اتفاق می افتد، یک تعامل ضعیف بین بار δ + اتم هیدروژن یک مولکول و δ- بار مولکول دیگر رخ می دهد. این برهمکنش را پیوند هیدروژنی می گویند. پیوند هیدروژنی بین مولکول های حاوی هیدروژن یک مولکول و اتم های الکترونگاتیو فلوئور، اکسیژن و نیتروژن از اتم دیگر تشکیل می شود. به عنوان مثال، ماهیت مایع آب با پیوندهای هیدروژنی بین مولکول های آب ایجاد می شود.
بیشتر بخوانید: پلیمرهای طبیعی کدامند و چه کاربردی دارند؟
پیوندهای هیدروژنی به آب ویژگی های منحصر به فردی می دهند که زندگی را حفظ می کنند. اگر پیوند هیدروژنی نبود، آب به جای اینکه در دمای اتاق باشد، گاز می بود. پیوندهای هیدروژنی می توانند بین مولکول های مختلف ایجاد شوند. اتم های هیدروژنی در پیوندهای قطبی درون هر مولکول می توانند با سایر مولکول های مجاور پیوند ایجاد کنند. به عنوان مثال ، پیوندهای هیدروژنی دو رشته طولانی DNA را بهم می چسباند و به مولکول DNA ساختار دو رشته ای مشخص خود را می دهد. پیوندهای هیدروژنی همچنین مسئول برخی از ساختارهای سه بعدی پروتئین ها هستند.
مقایسه قدرت پیوند یونی و کووالانسی
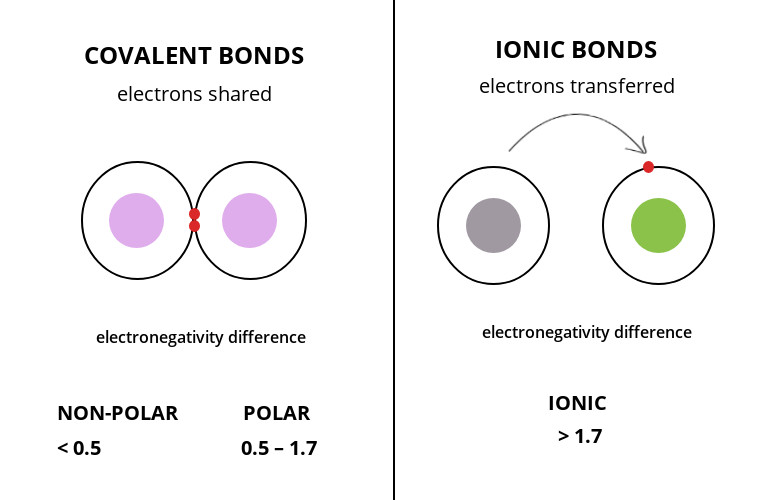
پیوند یونی از کووالانسی بسیار قوی تر است زیرا در یک پیوند یونی علت تشکیل پیوند بارهای ناهمنام است و همچنین در آن اتم ها الکترون خود را به طور کامل از دست می دهد و یا الکترون دیگری را می گیرد. اما در پیوند کووالانسی پیوند از به اشتراک گذاشتن الکترون ها به وجود می آید. پیوند یونی بین فلز و نافلز تشکیل می شود درحالیکه در پیوند کووالانسی دو نافلز داریم. همچنین اختلاف الکترونگاتیوی بین دو اتم در پیوند یونی بیشتر از کووالانسی است. به همین دلیل است که ترکیبات یونی نقطه جوش و ذوب بسیار زیادی دارند.
نوع پیوند شیمیایی لیتیم اکسید چیست؟
لیتیم اتمی درگرووه فلزات قلیایی است و با از دست دادن یک الکترون به کاتیون آن تبدیل می شود. اکسیژن نا فلزی در گروه ششم است که با گرفتن دو الکترون به آرایش هشت تایی می رسد و آنیون تشکیل می دهد. بنابراین پیوند بین این دو عنصر از نوع یونی است.
نوع پیوند بین ذرات آهن اکسید چیست؟
در ساختار آهن اکسید کاتیون آهن و آنیون اکسیژن وجود دارد که نشان دهده تشکیل پیوند یونی بود.






