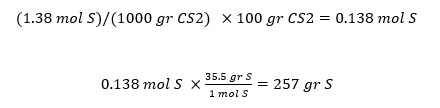خصوصیات فیزیکی را می توان به دو دسته تقسیم کرد. خواص شدتی و مقداری. حجم و جرم نمونه ای از خواص مقداری هستند، که به اندازه نمونه بستگی دارد. خواص شدتی مانند چگالی و غلظت، به اندازه نمونه مورد مطالعه بستگی ندارد. در این مقاله سعی داریم دسته سومی از این ترکیبات را به شما معرفی کنیم که زیرمجموعه ای از خواص شدتی هستند و به آن خواص کولیگاتیو گفته می شود.
خواص کولیگاتیو محلول ها
طبق تعریف یکی از خواص محلول است که فقط به نسبت تعداد ذرات حل شونده به تعداد ذرات حلال بستگی دارد و مستقل از ماهیت ذرات می باشد. تعداد بسیار کمی از خواص فیزیکی در گروه خواص کولیگاتیو قرار می گیرند. این خواص شامل فشار بخار، نقطه جوش، نقطه انجماد و فشار اسمزی می باشد.
نزول فشار بخار
می دانیم که P0 فشار بخار مایع خالص (حلال) و P فشار بخار حلال پس از افزودن یک حل شونده به حلال است. وقتی دمای مایع زیر نقطه جوش باشد، می توانیم فرض کنیم که تنها مولکول هایی که می توانند از مایع خارج شوند و به شکل گاز در می آیند، مولکول های سطح مایع هستند. زمانیکه حل شونده به حلال اضافه می شود، برخی از مولکول های حل شونده فضای نزدیک به سطح را اشغال می کنند. در نتیجه تعداد مولکول های حلال در سطح کاهش یافته و فشار بخار حلال کاهش می یابد.
این امر تاثیری در سرعت متراکم شدن مولکول های حلال در فاز گاز و تشکیل مایع ندارد. اما سرعت خروج مولکول های حلال و تبدیل به فاز گازی را کاهش می دهد. در نتیجه فشار بخار حلال خارج شده از یک محلول باید از فشار بخار حلال خالص کمتر باشد (P<P0).
قانون رائول
بین سال های 1887 و 1888 فرانسوا ماری و رائول نشان دادند که فشار بخار محلول برابر با جز مولی محلول در فشار بخار حلال خالص است.
P = X solvent P0
طبق قانون رائول وقتی حلال خالص باشد، کسر مولی حلال برابر با یک بوده و آنگاه P=P0 است. هرچه کسر مولی کوچکتر باشد، به همان نسبت فشار بخار حلال خارج شده از محلول نیز کوچکتر می شود.
بیایید برای لحظه ای فرض کنیم که حلال تنها جز یک محلول با فشار بخار قابل اندازه گیری باشد. در این حالت فشار بخار محلول برابر با فشار بخار حلال خارج شده از محلول خواهد بود. قانون رائول پیشنهاد می کند که اختلاف بین فشار بخار حلال خالص و محلول با کاهش کسر مولی حلال، افزایش می یابد.
تغییر در فشار بخار که هنگام افزودن یک ماده حل شونده به یک حلال ایجاد می شود، به همین جهت فشار بخار یک خاصیت کولیگاتیو است. چرا که به کسر مولی حلال و محلول بستگی دارد و به هویت آن تاثیری ندارد.
محاسبه فشار بخار
برای محاسبه فشار بخار محلول از قانون رائول استفاده می شود. به مثال زیر توجه کنید:
مثال: فشار بخارمحلول ایده آلی شامل 100 گرم آب و 50 گرم سدیم کلرید را در دمای اتاق محاسبه کنید. فشار بخار آب در دمای 25 درجه سانتیگراد، 23.76 mmHg است.
برای محاسبه ابتدا فشار بخار آب را بر حسب اتمسفر محاسبه می کنیم. می دانیم 1 اتمسفر برابر با 760 mmHg است. بنابراین خواهیم داشت:
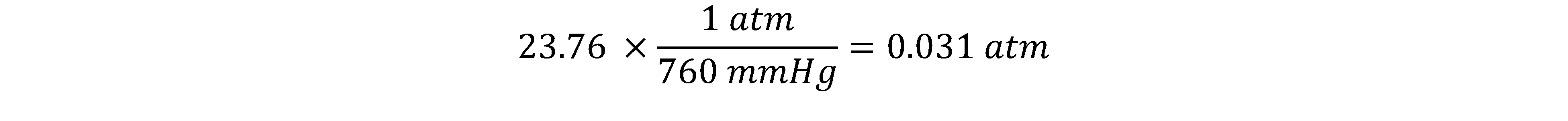
به علت اینکه تنها جز فرار در این محلول حلال است از قانون رائول برای محاسبه فشار بخار استفاده می کنیم:
P = X solvent P0
بنابراین ابتدا جز مولی حلال را حساب می کنیم. برای این کار نیاز به مقدار مول مواد تشکیل دهنده محلول داریم:
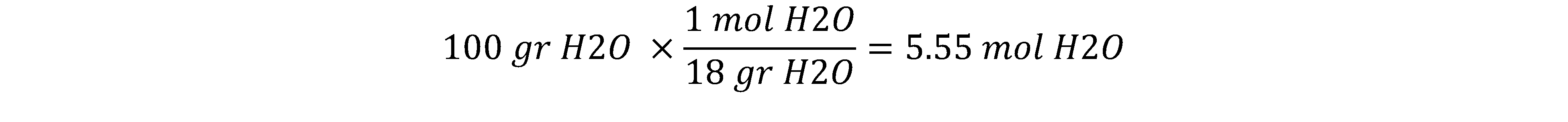
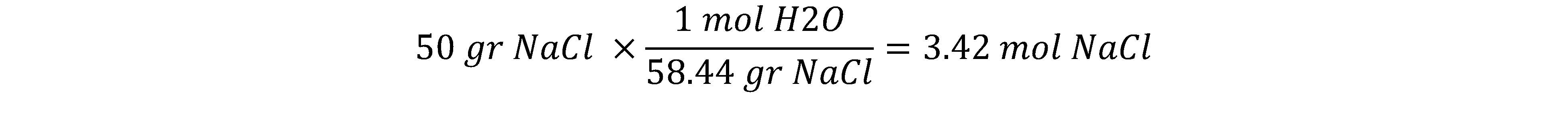
در این مرحله کسر مولی را محاسبه کرده و سپس با استفاده از قانون رائول فشار بخار را محاسبه می کنیم:
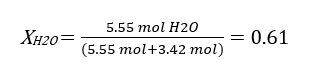
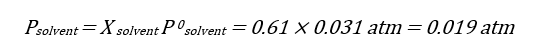
نقطه سه گانه
با توجه به شکل زیر، می توانیم ببینیم که فشار بخار حلال با افزودن یک حل شونده کاهش می یابد. خط اتصالی که در این نمودار فازی نقاط B و C را به یکدیگر متصل می کند شامل ترکیبی از دما و فشار است. در آن حلال خالص و بخار آن در تعادل هستند.
بنابراین هر نقطه از این خط فشار بخار حلال خالص را در آن دما توصیف می کند. خط نقطه چین خصوصیات محلول را نشان می دهد. در هر دما، فشار بخار محلول، کوچکتر از فشار بخار حلال است.
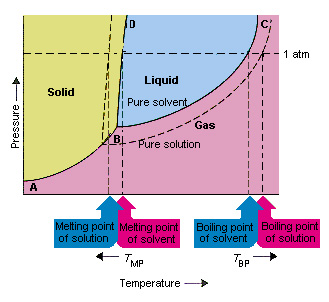
بنابراین، محلول نمی تواند در دمایی که یک حلال خالص می جوشد، به جوش آید. اگر فشار بخار محلول کوچکتر از فشار بخار حلال خالص در هر دمایی باشد، محلول نیاز به دماهای بیشتری برای رسیدن به نقطه جوش دارد.
در نمودارهای فازی، نقطه سه گانه نقطه ای است که در آن ترکیبی از حالت های گاز، مایع و جامد در دما و فشار خاص به طور همزمان وجود دارند. شکل بالا نشان می دهد که نقطه سه گانه محلول در دمای پایین تری نسبت به نقطه سه گانه حلال خالص رخ می دهد. تغییر در نقطه سه گانه مهم نیست. اما نتیجه آن تغییر دمایی است که محلول در آن یخ می زند یا ذوب می شود. خطی که فازهای جامد و مایع را در نمودار جدا می کند تقریباً عمودی است. زیرا نقطه ذوب ماده به فشار خیلی حساس نیست. افزودن یک ماده حل شونده به یک حلال، نحوه وابستگی نقطه ذوب به فشار را تغییر نمی دهد.
خطی که مناطق جامد و مایع محلول را جدا می کند موازی با خطی است که برای حلال خالص است. کاهش در نقطه سه گانه که هنگام حل شدن یک املاح در یک حلال رخ می دهد، منجر به کاهش نقطه ذوب محلول می شود.
افزایش نقطه جوش و کاهش نقطه انجماد
شکل بالا نشان می دهد که چگونه تغییر در فشار بخار که هنگام حل شدن یک ماده حل شونده در یک حلال ایجاد می شود منجر به تغییر در نقطه ذوب و نقطه جوش حلال می شود. از آنجا که تغییر فشار بخار یک خاصیت کولیگاتیو است، فقط به تعداد نسبی ذرات حل شونده و حلال بستگی دارد. تغییرات در نقطه جوش و نقطه ذوب حلال نیز از خواص کولیگاتیو هستند.
بیشتر بخوانید: انواع پیوندهای شیمیایی
فشار اسمزی
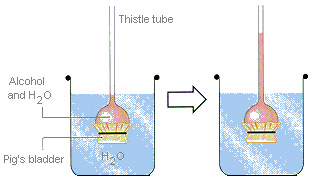
در سال 1784، ژان آنتوان نولت، فیزیکدان و روحانی فرانسوی کشف کرد که مثانه خوکی که با محلول غلیظ الکل در آب پر شده است، هنگام غوطه ور شدن در آب، منبسط می شود. مثانه به عنوان غشایی نیمه نفوذ پذیر عمل می کند. به مولکول های آب اجازه می دهد وارد محلول شوند، اما از حرکت مولکول های الکل در جهت دیگر جلوگیری می کند. حرکت یک جز محلول از محلولی با غلظت بیشتر به محلول با غلظت کمتر از طریق غشا نیمه تراوا، اسمز نامیده می شود. فشار ایجاد شده در نتیجه آن فشار اسمزی نامیده می شود.
فشار اسمزی را می توان با دستگاه ارائه شده در شکل زیر نشان داد. غشای نیمه تراوا به انتهای باز لوله تیستل متصل است. سپس لوله با محلول قند یا الکل در آب پر شده و در یک لیوان آب غوطه ور می شود. آب تا زمانی که فشار وارد شده به ستون آب در اثر نیروی گرانش متعادل کننده فشار اسمزی متعادل شود، به درون لوله جریان می یابد.
در همان سال که رائول رابطه بین فشار بخار یک محلول و فشار بخار یک حلال خالص را کشف کرد، Jacobus Henricus van’t Hoff دریافت که فشار اسمزی محلول رقیق مطابق با معادله گاز ایده آل است.
این معادله نشان می دهد که فشار اسمزی یک خاصیت کولیگاتیو است. زیرا فشار اسمزی به نسبت تعداد ذرات حل شونده به حلال بستگی دارد و فارغ از ماهیت ذرات است. طبق این معادله یک محلول یک مولار در دمای صفر درجه سانتیگراد دارای فشار اسمزی 22.4 است.
بیشتر بخوانید : واکنش های شیمیایی و انواع آن
محاسبات خواص کولیگاتیو
بهترین راه برای نشان دادن اهمیت خواص کولیگاتیو، بررسی قانون رائول است. رائولت دریافت که فشار بخار حلال خارج شده از محلول متناسب با کسر مولی حلال است.
P = Xsolvent P0
اما فشار بخار حلال خاصیت کولیگاتیو نیست. فقط تغییرات فشار بخار زمانیکه حل شونده به حلال اضافه می شود، می تواند جزو خواص کولیگاتیو باشد. زیرا فشار یک عامل پایه است، و تغییرات فشار بخار حلال زمانیکه حل شونده به حلال اضافه می شود می تواند به عنوان اختلاف فشار بخار حلال خالص و محلول است. بنابراین می توان قانون رائول را به این صورت نوشت:
P = P0 – P
P = P0 – Xsolvent P0 = (1 – Xsolvent) Po
با به خاطر سپردن رابطه بین کسر مولی ماده حل شونده و کسری مول حلال می توان این معادله را ساده کرد.
X solvent + X solute = 1
جایگزینی این رابطه در معادله ای که P را تعریف می کند، شکل دیگری از قانون رائول را ارائه می دهد.
P = X solute P0
این معادله به ما یادآوری می کند که تغییر فشار بخار حلال که هنگام افزودن املاح به حلال اتفاق می افتد متناسب با کسر مولی املاح است. با حل شدن بیشتر املاح در حلال، فشار بخار حلال کاهش یافته و تغییر فشار بخار حلال افزایش می یابد. از آنجا که تغییرات نقطه جوش یک حلال زمانی اتفاق می افتد که یک ماده حل شونده به حلال اضافه شود در نتیجه تغییرات فشار بخار محلول ایجاد می شود، اندازه گیری تغییرات نقطه جوش نیز با کسر مولی حل شونده متناسب است.
T BP = k b solute∆
همانطور که در شکل زیر نشان داده شده است، در محلول های رقیق، کسر مولی محلول متناسب با مولالیته محلول است.
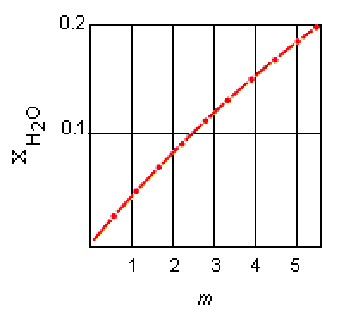
معادله افزایش نقطه جوش
معادله ای که مقدار افزایش نقطه جوش را توصیف می کند که هنگام افزودن یک ماده حل شونده به یک حلال رخ می دهد، اغلب به صورت زیر نوشته می شود:
∆TBP = kb m
در اینجا ∆TBP افزایش نقطه جوش است و kb یک ثابت تناسب است که به عنوان ثابت افزایش نقطه جوش مولال برای حلال شناخته می شود.
معادله ای مشابه را می توان برای توصیف آنچه در نقطه انجماد (یا نقطه ذوب) یک حلال هنگام اضافه شدن یک ماده حل شونده به حلال اتفاق می افتد، نوشت.
∆TFP = -kf m
دراین معادله ∆TFP میزان کاهش نقطه انجماد و -kf ثابت تناسبی با عنوان ثابت کاهش نقطه انجماد مولال برای حلال است. علامت منفی نشانگر کاهش نقطه انجماد حلال پش از افزودن حل شونده است.
تعیین وزن مولکولی با روش افزایش نقطه جوش
اجازه بدهید این روش را با یک سوال مطرح کنیم:
سوال: اگر 35.5 گرم در اکسید سولفور را در 100 گرم CS2 را حل کنیم تا محلولی با نقطه جوش 49.48 درجه سانتیگراد تولید شود. وزن مولکولی گوگرد را محاسبه کنید. kb = 2.53
پاسخ: رابطه بین نقطه جوش محلول و وزن مولکولی گوگرد مشخص نیست. بنابراین ما با این سوال شروع به حل سوال می کنیم: درباره این مشکل چه می دانیم؟
ما نقطه جوش محلول را می دانیم، بنابراین می توانیم از آن شروع کنیم تا تغییر در نقطه جوش را محاسبه کنیم.
∆TBP = 49.48 – 46.23 = 3.25 °C
حال از معادله افزایش نقطه جوش استفاده می کنیم:
∆TBP = kb m
3.25 = 2.53 × m
m = 1.38 mol/L
در ادامه مولالیته را به مول و سپس به گرم تبدیل می کنیم: