قلع چیست؟ چه کاربرد هایی دارد؟ خواص آن چیست؟ در این مقاله بخوانید:
قلع با نماد Sn متعلق به گروه خانواده ی کربن (گروه چهاردهم از جدول تناوبی) است. این فلز ، نرم و به رنگ نقره ای مایل به آبی می باشد. برنز نیز که از دیرباز شناخته می شود، آلیاژی از این ماده به همراه مس است. این آلیاژ سال ها پیش از کشف قلع خالص، در بین النهرین، پرو و مصر مورد استفاده قرار می گرفت.این فلز مهم به طور گسترده ای برای آبکاری قوطی های استیل مورد استفاده به عنوان ظروف غذا و لحیم کاری استفاده می شود.
تاریخچه:
بخش اعظم قلع مورد استفاده مردمان اولیه مدیترانه به جزایر Scilly و Cornwall در بریتانیا بر می گردد. در این مناطق تاریخ استخراج این ماده حدود حداقل 300الی200 سال قبل از میلاد مسیح است.
نماد Sn برای قلع ، مخفف کلمه لاتین stannum می باشد.
خواص و ویژگی ها:
ویژگی های این ماده را در جدول زیر می توانید مشاهده کنید:
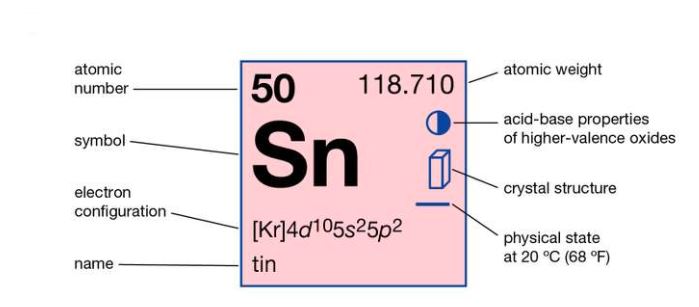
| عدد اتمی | 50 |
| وزن مولکولی | 118.69 |
| نقطه ی ذوب | 231.97 °C |
| نقطه ی جوش | 2,270 °C |
| دانسیته (سفید ) | 7.28 |
| دانسیته ( نقره ای) | 5.75 grams/cm3 |
این ماده غیر سمی، نرم و قابل انعطاف است. رنگ این ماده در برابر هوا عوض نمی شود. زیرا یک لایه ی نامرئی محافط در برابر مجاورت با هوا بر روی این فلز تشکیل می شود.
پایین بودن نقطه ذوب قلع و چسبندگی بالای آن به سطوح آلیاژهای آهن ، فولاد ، مس موجب استفاده از این ترکیب به عنوان یک پوشش مقاوم در برابر اکسیداسیون شده است.
این فلز با اسیدها و قلیاهای قوی واکنش می دهد ، اما محلول های تقریباً خنثی تاثیری قابل ملاحظه ای بر روی آن نمی گذارند. کلر ، برم و ید با این ماده واکنش نشان می دهند اما فلوئور به آرامی در دمای اتاق با آن وارد واکنش می شود.
انواع
این فلز به دو صورت (دو آلوتروپ ) موجود می باشد:
- سفید یا بتا ( فرم معمول تر )
- خاکستری یا آلفا: پودری شکل ، با کاربرد کمتر
فرم خاکستری در دمای 13.2 درجه ی سانتی گراد (55.8 درجه فارنهایت) به فرم سفید تبدیل می گردد. این تبدیل در دما های بالای 100 درجه ی سانتی گراد با سرعت بیشتری انجام می شود. فرایند برعکس این تبدیل را اصطلاحا آفت قلع می گویند. در آفت قلع فرم بتا به آلفا تبدیل می گردد. این تغییرات در دماهای بسیار سرد (-50 درجه ی سانتی گراد) باسرعت بیشتری رخ می دهد مگر آنکه توسط قلع خاکستری یا قلع خاکستری در حالت اکسیداسیون +4 کاتالیز شود .این فرایند منجر می شود تا در مناطق سرد استفاده از این ماده محدودتر شود. معمولا با افزودن مقادیر اندک آنتیموان ، بیسموت ، مس ، سرب ، نقره یا طلا در گرید های تجاری این ماده از این فرایند جلوگیری به عمل می آورند.
معادن
این ماده در سنگ های آذرین درونی تا حدود 0.001درصد وجود دارد. این مقدار از این ترکیب کمیاب می باشد اما نادر نیست. مقدار فراوانی این ماده همانند عناصر دیگری مانند کبالت ، نیکل ، مس ، سریم ، سرب و برابر با فراوانی نیتروژن است.
کاربرد ها
- آبکاری این ماده بر روی سطوح آهنی موجب حفط آهن از خوردگی می شود. در نتیجه معمولا برای پوشش دهی سطوح شیر آلات و دستگیره ها از این فلز استفاده می نمایند.
- اکسید قلع ، که Sn در حالت اکسیداسیون +4 است ، در ساخت اجسام سرامیکی مات ، به عنوان یک ساینده خفیف و به عنوان ماده وزنی برای پارچه ها مورد استفاده قرار می گیرد.
- قلع فلوئورید و پیروفسفات قلع ، که Sn در حالت اکسیداسیون +2 می باشند ، در تهیه ی خمیر دندان ها مورد استفاده قرار می گیرند.
- ترکیبات آلی این ماده در ساخت پلاستیک های خاص به عنوان نگهدارنده و برای چوب ها به عنوان تثبیت کننده عمل می کنند.
- آلیاژ این ماده با نیوبیم Nb می تواند ابر رسانایی در دمای بالاتر از 18 کلوین (−427 فارنهایت ) ،ایجاد کند.






