تیتراسیون(Titration) چیست؟ این روش که در انواع رسوبی، اکسایش کاهش و… موجود می باشد یک روش آسان و کاربردی برای تعیین غلظت محلول مجهول است و به صورت افزودن آهسته ی یک محلول با غلظت معلوم به حجم مشخصی از یک محلول دیگر با غلظت نامشخص گفته می شود. این فرایند تا زمانی ادامه می یابد که واکنش در نقطه ی هم ارزی به خنثی شدن برسد و با تغییر رنگ پایان واکنش اعلام گردد. به دست آوردن این نقطه ی پایانی با تغییر رنگ و با کمک شناساگر، قابل شناسایی خواهد بود.
این فرایند به منظور تعیین غلظت گونه ی مجهول و همچنین مشخص کردن درصد خلوص مورد استفاده قر ار می گیرد. در این مقاله به توضیح کامل تیتراسیون اسید و باز، رسم منحنی و تفسیر آن ها، تفاوت های میان نوع مستقیم، غیر مستقیم ، برگشتی یا معکوس کاربرد های آن و خطاهای این روش بیشتر می پردازیم. پس با ما همراه باشید.
قبل از شروع به بحث در مورد این روش و نمودار های آن ، برای درک بهتری تیتراسیون اسید و باز به بررسی اسید قوی /ضعیف و باز قوی/ضعیف توجه کنید:
بررسی اسید و باز
اسید قوی در محلول به صورت یون هیدرونیوم تجزیه می گردد:
HCl + H2O → H3O+ + Cl–
اما اسید ضعیف همانند نوع قوی آن نمی تواند به طور کامل به شکل یون هیدرونیوم تجزیه گردد:
CH3COOH + H2O ↔ CH3COO– + H3O+
این فرایند برای باز ها نیز به صورت یون هیدروکسیل اتفاق می افتد:
NaOH → Na+ + OH-
اما باز ضعیف به صورت کامل در محلول به فرم OH- تبدیل نمی شود:
NH4OH ↔ NH4+ + OH–
مثالی از انواع ضعیف و قوی این مواد را می توانید در زیر مشاهده نمایید:
| اسید قوی
|
هیدروکلریک اسید(HCl)،
سولفوریک اسید (H2SO4)، نیتریک اسید (HNO3) |
| اسید ضعیف | هیدروفلوئوریک اسید (HF)،
اسید اگزالیک 2(COOH) اسید استیک (CH₃COOH) فرمیک اسید (CH₂O₂) اسید فسفریک (H3PO4) |
| باز قوی | سدیم هیدروکساید (NaOH)، پتاسیم هیدروکساید (KOH)،
لیتیم هیدروکساید (LiOH) |
| باز ضعیف
|
آمونیوم هیدروکساید (NH4OH)،
آمونیوم (NH3) |
اسید ضعیف و باز ضعیف همیشه به صورت مزدوج در محلول ظاهر می شوند:
HA + H2O ↔ H3O+ + A–
در بالا HA اسید و A- باز مزدج HA به حساب می آید.
A– + H2O ↔ OH– + HA
در واکنش بالا –A باز و HA اسید مزدج –A به حساب می آید
قاعده ی اساسی: اسید های ضعیف دارای باز های مزدوج قوی می باشند در حالی که باز های ضعیف دارای اسیدهای مزدوج قوی هستند.
همانطور که در دو واکنش بالا نیز مشاهده شد اگر HA اسیدی ضعیف باشد بنابراین A- باز قوی این فرایند به حساب می آید.
تعریف تیتراسیون
تیتراسیون یک تکنیک برای تعیین غلظت یک محلول ناشناخته و یا تعیین غلظت آن می باشد.
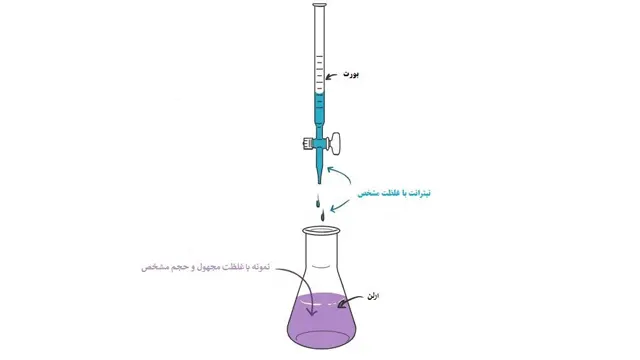
همانطور که در شکل بالا نیز نشان داده شده است یک محلول با غلظت شناخته شده (تیترانت) برای تعیین یک محلول با غلظت مجهول(نمونه یا آنالیت) به کار گرفته شده است. به طور معمول تیترانت (محلول با غلظت مشخص) از طریق بورت به حجم مشخصی از آنالیت به صورت قطره قطره افزوده می شود تا زمانی که واکنش کامل گردد
دانستن حجم تیترانت خوانده شده از روی بورت می تواند به ما در محاسبه ی غلظت آنالیت مورد نظر کمک نماید. اغلب یک شناساگر نیز برای تعیین پایان واکنش مورد استفاده قرار می گیرد. تیترانت و نمونه باید به گونه ای باشند که به صورت جفت اسید-باز انتخاب گردند.
در واقع تیتراسیون اسید و باز بر پایه ی تغییر pH واکنش صورت می پذیرد.
اصطلاحات تیتراسیون اسید و باز :
تیترانت:به محلولی که دارای غلظتی معین بوده و جهت تعیین غلظت مجهول محلول دیگری استفاده می شود تیتران تگفته می شود و معمولا در بورت ریخته می شود.
آنالیت یا نمونه: ترکیبی که غلظت مجهول دارد و می خواهیم غلظت آن را تعیین کنیم.
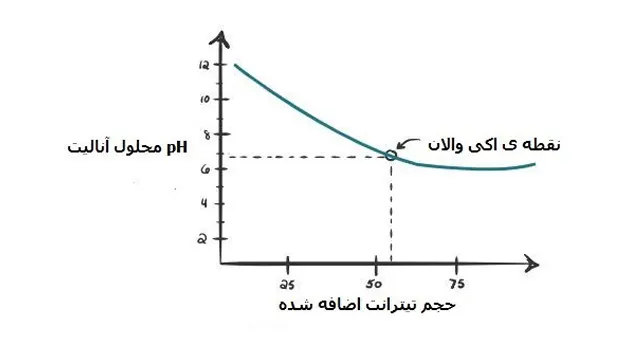
نقطه ی هم ارز (نقطه ی اکی والان) : زمانیکه نسبت های مولی نمونه و تیترانت یکسان باشد و به طور کامل با هم واکنش داده باشند گفته می شود تیتراسیون به نقطه هم ارزی رسیده است. در این نقطه میزان اکی والان های آنالیت و تیترانت برابرمی باشد.
HCl + NaOH → NaCl + H2O
شناساگر: برای آشنایی با شناساگر بهتر است بدانید این ماده یک اسید و یا باز ضعیف می باشد
که به محلول آنالیت افزوده می گردد و موجب می شود تا در هنگام رسیدن به نقطه ی اکی والان شاهد تغییر رنگ محلول باشیم.
در واقع نقطه ی اکی والان نشان می دهد که مصرف این مقدار حجم از تیترانت برای خنثی سازی آنالیت کافی بوده است.
نقطه ای که شناساگر موجب تغییر رنگ محلول می شود را نقطه ی پایانی می گویند.
بنابراین اضافه کردن یک شناساگر به ما کمک می کند نقطه ی اکی والان را در تیتراسیون اسید و باز به صورت بصری مشاهده نماییم.
نقطه ی پایانی: نقطه ای از تیتراسیون اسید و باز می باشد که در آن شاهد تغییر رنگ محلول توسط شناساگر هستیم.
تفاوت نقطه ی هم ارزی و نقطه ی پایانی در چیست؟
نقطه ی هم ارزی بیشتر مفهومی ریاضی دارد. در این نقطه غلظت یون های هیدروکسید و یون های هیدروژن موجود در محلول با یکدیگر برابر می باشند و محلول خنثی می گردد.
- اما در حین آزمایش از کجا بفهمیم به این نقطه رسیده ایم؟؟
شما با مشاهده ی اولین تغییر رنگ در محلول می توانید پی ببرید که به نقطه ی هم ارزی رسیده اید. باید توجه نمود که نقطه ی پایانی فاصله ی اندکی با نقطه ی هم ارزی دارد. پابان واکنش و رسیدن به نقطه ی پایانی زمانی اعلام می گردد که تغییر رنگ در محلول ثابت گردد.
مواد لازم برای انجام تیتراسیون حجمی
- ارلن مایر
- بشر
- بورت، پایه ی نگه دارنده ی بورت
- پیپت، پوآر
- بالن
- ترازو
- قیف
- مزور
آموزش تیتراسیون
مراحل تیتراسیون اسید و باز (باز قوی با اسید قوی):
برای این کار ابتدا تیترانت را در بورت می ریزم و حجم اولیه آن را یادداشت می کنیم. در مرحله بعد حجم مشخصی از نمونه را با پیپت اندازه گرفته و درون ارلن می ریزیم. حال از یک شناساگر مانند فنول فتالئین یا متیل اورانژ استفاده می کنیم. هرچه شناساگر کمتری بریزیم دقت کار بیشتر می باشد، بنابراین یک قطره اضافه می کنیم. حال ارلن را زیر بورت گرفته و شیر بورت را به آهستگی باز می کنیم، به طوری که قطره قطره تیترانت به نمونه اضافه شود و همزمان نیز ارلن را تکان می دهیم تا تیترانت و نمونه مخلوط شوند. این کار را تا زمانی که به نقطه هم ارزی برسیم ادامه می دهیم. به محض مشاهده تغییر رنگ شیر بورت را بسته و حجم پایانی را یادداشت می کنیم و از اختلاف حجم نهایی مصرفی اسید موجود در بورت و حجم ابتدایی آن مقدار حجم مصرفی به دست می آید و از آن در محاسبات استفاده می نماییم.
نکته: برای بالا بردن دقت در آزمایش تیتراسیون اسید و باز لازم است که آزمایش سه مرتبه تکرار گردد و میانگینی از حجم های به دست آمده به عنوان حجم تیتراسیون گزارش گردد.
نمودار های تیتراسیون :
نمودار های تیتراسیون از نقاطی شامل pH محلول آنالیت بر حسب حجم تیترانت افزوده شده در طی فرایند titration تشکیل می گردد.
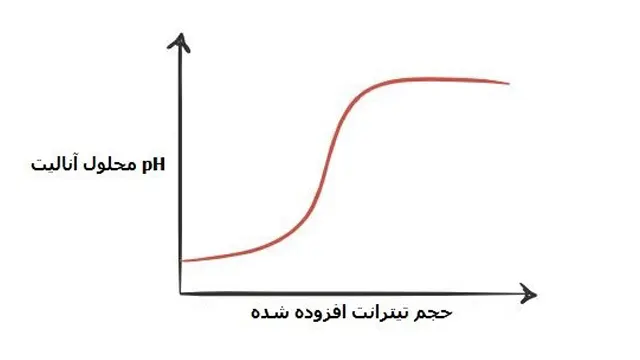
در ادامه به بررسی چند نمونه از این نمودار های رایج در تیتراسیون اسید و باز می پردازیم:
1-تیتراسیون اسید قوی و باز قوی:
فرض کنید آنالیت ما اسید کلریدریک با فرمول شیمیایی HCl و تیترانت مورد استفاده سدیم هیدروکساید با فرمول شیمیایی NaOH می باشد.
اگر شروع به رسم نقاط pH به دست آمده ی آنالیت بر حسب حجم NaOH مصرفی از بورت کنیم
نمودار تیتراسیون آن به صورت زیر نشان داده می شود:
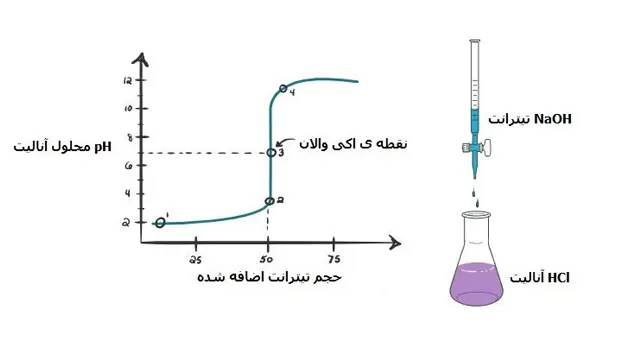
تفسیر نمودار:
نقطه ی 1:
در نقطه ی 1 به دلیل افزوده نشدن NaOH به محلول ، pH آنالیت پایین می باشد که عمدتا به دلیل وجود +H3O حاصل از تفکیک HCl است.
HCl + H2O → H3O+ + Cl–
از آنجایی که قطره قطره محلول سدیم هیدروکسید موجود در بورت به آنالیت افزوده می شود شاهد تغییر در pH و بالا رفتن آن می باشیم.
با افزوده شدن سدیم هیدروکساید یون هیدرونیوم با یون هیدروکسیل بازی وارد واکنش می شود
اما به دلیل غالب بودن مقدار یون هیدرونیوم، همچنان آنالیت اسیدی خواهد بود.
2:
این pH درست در زمانی ثبت می شود که خنثی سازی کامل انجام نگرفته است.
3:
این نقطه را نقطه ی اکی والان می نامند در این نقطه تعداد مول های اضافه شده ی سدیم هیدروکساید برابر با تعداد مول های HCl می باشد.
و در آن یون هیدرونیوم توسط یون هیدروکسید خنثی می گردد.
محلول در این pH تنها شامل نمک و آب می باشد پس بنابراین pH آن خنثی و برابر 7 خواهد بود.
HCl + NaOH ↔ NaCl + H2O
4:
با ادامه پیدا کردن افزایش سود به محلول، pH افزایش پیدا می کند و محلول بازی می گردد.
زیرا هیدروکلریک اسید به طور کامل خنثی گردیده و شاهد افزایش یون هیدروکسید به دلیل تفکیک NaOH در محلول هستیم.
بعد از نقطه ی اکی والان: –NaOH→ Na++OH
2- تیتراسیون اسید قوی با باز قوی :
نمودار های این گروه در تیتراسیون اسید و باز نیز همانند مورد قبلی می باشد با این تفاوت که در اول به دلیل اینکه آنالیت مورد استفاده سود می باشد شاهد بالا بودن pH هستیم و با افزودن اسید کاهش PH را شاهد خواهیم بود:
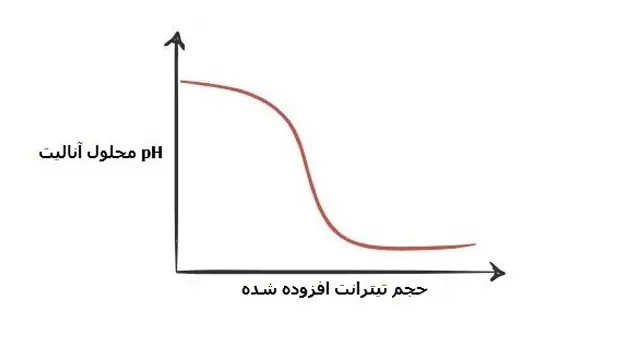
فرض کنید آنالیت ما سدیم هیدروکسید با فرمول شیمیایی NaOH و تیترانت مورد استفاده HCl می باشد.
اگر شروع به رسم نقاط pH به دست آمده ی آنالیت بر حسب حجم HCl مصرفی از بورت کنیم نمودار تیتراسیون آن به صورت زیر نشان داده می شود:
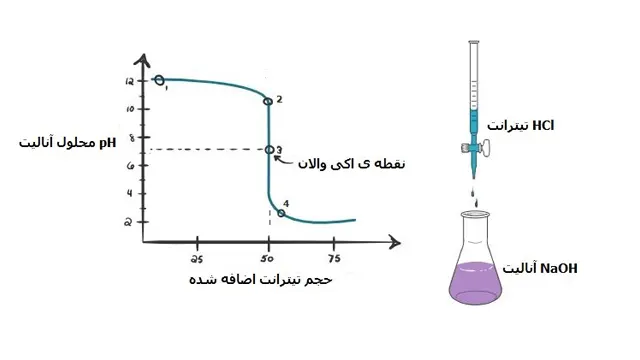
1:
در نقطه ی 1 به دلیل افزوده نشدن HCl به محلول ، pH آنالیت بالا می باشد که عمدتا به دلیل وجود –OH حاصل از تفکیکNaOH است.
NaOH + H2O → Na+ + OH–
از آنجایی که قطره قطره محلول سدیم هیدروکساید موجود در بورت به آنالیت افزوده می شود
شاهد تغییر در pH و بالا رفتن آن می باشیم.
با افزوده شدن سدیم هیدروکساید یون هیدرونیوم با یون هیدروکسیل بازی وارد واکنش می شود
اما به دلیل غالب بودن مقدار یون هیدروکسیل، همچنان آنالیت بازی خواهد بود.
2:
این pH درست در زمانی ثبت می شود که خنثی سازی کامل انجام نگرفته است
3:
این نقطه را نقطه ی اکی والان می نامند در این نقطه تعداد مول های اضافه شده یHCl برابر با تعداد مول های سدیم هیدروکساید می باشد.
و در آن یون هیدروکسیل توسط یون هیدرونیوم خنثی می گردد.
محلول در این pH تنها شامل نمک و آب می باشد پس بنابراین pH آن خنثی و برابر 7 خواهد بود.
HCl + NaOH ↔ NaCl + H2O
4:
با ادامه پیدا کردن افزایش HCl به محلول، pH کاهش پیدا می کند و محلول اسیدی می گردد.
زیرا سدیم هیدروکساید به طور کامل خنثی گردیده و شاهد افزایش یون هیدرونیوم به دلیل تفکیک HCl در محلول هستیم.
بعد از نقطه ی اکی والان: –HCl→ H3O++Cl
سایر تیتراسیون ها:
تیتراسیون اسید و باز به همین جا ختم نمی گردد و انواع گوناگونی دارند که از انواع دیگر این تیتراسیون ها می توان به موارد زیر اشاره نمود:
- اسید ضعیف با باز قوی
- اسید قوی با باز ضعیف
- باز ضعیف با اسید ضعیف
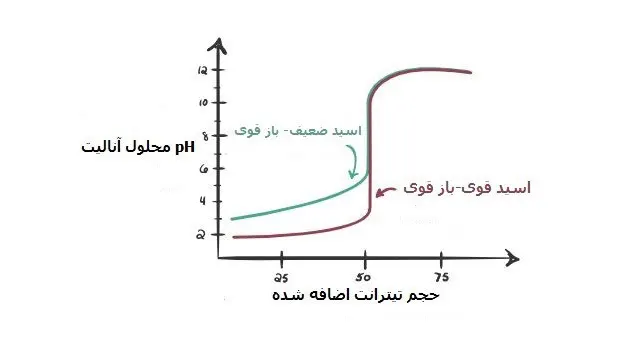
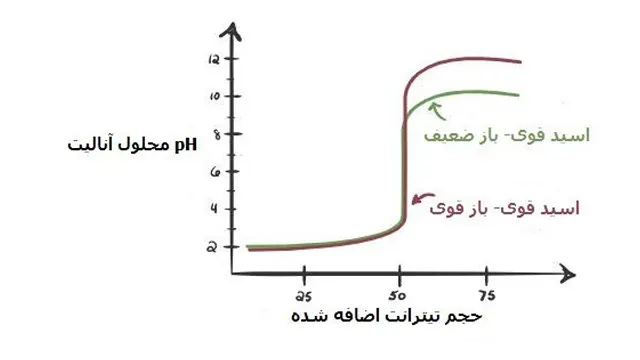
در شکل زیر نمودار های انواع تیتراسیون اسید و باز رسم گردیده است:
-
اسید ضعیف با باز قوی
-
اسید قوی با باز ضعیف
-
باز ضعیف با اسید ضعیف
خطای تیتراسیون چیست؟
نقطه هم ارزی یک نقطه تئوری است در حالیکه نقطه پایانی قابل مشاهده است. اگر تیتراسیون به درستی و با دقت انجام شود، این دو نقطه یکسان خواهند بود. حال اگر دقت کافی در انجام تیتراسیون نباشد منجر به ایجاد خطای محاسباتی و در نتیجه خطا در تعیین غلظت نمونه می شود.
عوامل خطا در آزمایش تیتراسیون اسید و باز قوی
- کالیبره نبودن وسایل آزمایشگاهی مورد استفاده در ازمایشگاه مانند بشر، بورت و…
- استاندارد نبودن تیترانت مورد استفاده برای تیتراسیون اسید و باز ( اسید یا باز مورد استفاده به عنوان تیترانت اول باید با کمک KHP استاندارد گردد و غلظت دقیق آن محاسبه شود) همچنین می توان از تیترازول های آماده برای فروش استفاده نمود.
- استفاده از روش دقیق برای تعیین نقطه پایانی
در میان موارد گفته سومین مورد بیشترین تاثیر را در ایجاد خطا دارد. در واقع استفاده از روش چشمی برای تعیین نقطه پایانی راه مطمئن و بدون خطایی نیست. به همین جهت از روش های دیگری نیز برای تعیین نقطه پایانی با کمک وسایل مربوطه استفاده می شود.
انواع تیتراسیون
در این مقاله تا به اینجا به بررسی نوع اسید و باز تیتراسیون پرداختیم. اما این روش انواع گوناگونی دارد که بسته به نمونه ی آزمایشی می تواند انواع مختلفی از آن مورد استفاده قرار بگیرد. از جمله سایر انواع این فرایند می توان به موارد زیر اشاره نمود.
-
کمپلکسومتری:
در این واکنش اغلب یون های فلزی با معرف دی سدیم اتیلن دی آمین تترااستات( ادتا) به عنوان تیترانت وارد واکنش می شوند. در این فرایند نمونه ی جامد از محلول خارج می شود و عموما برای اندازه گیری مخلوط یون های فلزی مختلف موجود در محلول مورد استفاده قرار می گیرد. تشخیص نقطه ی پایانی در این فرایند معمولا به دو روش صورت می گیرد:
1-شناساگر های بصری: (شامل شناساگر های pH، شناساگر های ردوکس و شناساگر Metallochromic یا PM می باشد) 2- روش های ابزاری: با این حال استفاده از روش های بصری در تعیین نقطه پایانی محدودیت هایی از جمله عدم صحت یا خطاهای انسانی را دارد در نتیجه استفاده از ابزار آلات به جای انسان خطاهای کمتری را در پی خواهد داشت. برخی از تکنیک های ابزاری که در تعیین نقطه پایانی استفاده می شوند عبارتند از: 1-فتومتر 2-پتانسیومتری 3-روش های متفرقه.
- یدومتری:
به هر واکنشی که در آن ید اکسید شود یدومتری می گویند. همانطور که می دانید ید یک کاهنده است و بر اساس این ویژگی ای که دارد می تواند در شناسایی و تعیین غلظت بسیاری از ترکیبات استفاده شود. در تیتراسیون یدومتری ید نقش شناساگر داشته و معمولا از تیوسولفات به عنوان تیترانت برای آن استفاد می شود. عناصر مختلفی را می توان با روش یدومتری تعیین کرد که یکی از ان ها مس است. همچنین این روش یکی از مطمئن ترین روش ها برای تعیین میزان اکسیژن محلول در آب است.
-
اکسایش و کاهش:
این فرایند که به نوع ردوکس نیز معروف است، یک واکنش ردوکس (یا کاهش اکسیداسیون) است که شامل انتقال الکترون بین دو گونه است.از تیتراسیون ردوکس می توان برای مطالعه آلودگی در آب آشامیدنی یا تعیین غلظت فلزات در یک محلول استفاده کرد.
-
رسوبی:
این روش برای تعیین مقدار عنصر کاربرد دارد. به عنوان مثال در تعیین کلر با کمک نقره نیترات، کلر به صورت نقره کلرید رسوب می کند. در این فرایند نیز همانند نوع کمپلکسومتری نمونه ی جامد از محلول خارج می شود. اما تفاوت این دو فرایند در این است که در روش کمپلکسومتری جامد خیلی سریع رت و کاملتر تشکیل می شود و همین امر خطاهای موجود را به حداقل می رساند.
اکسایش و کاهش
در این فرایند مانند تیتراسیون اسید و باز، غلظت گونه ی مجهول را می توان محاسبه نمود با این تفاوت که اینجا غلظت گونه ی مجهول آنالیت، عامل اکسایش و یا کاهش می باشد. در همه ی انواع این تیتراسیون ها استفاده از شناساگر ضروری نمی باشد و خود تیترانت می تواند به عنوان شناساگر عمل نماید. به عنوان مثال پتاسیم پرمنگنات می تواند شناساگر مناسبی در برخی فرایند های اکسایش و کاهش باشد و سبب تغییر رنگی مشهود از بی رنگ به ارغوانی ( حاصل از پرمنگنات های واکنش نکرده در محلول) گردد.
-
مثال1:
از معروفترین فرایندهای اکسایش کاهش می توان به یافتن غلظت یون های مجهول اهن دو ظرفیتی با کمک پتاسیم پرمنگنات اشاره نمود. واکنش این فرایند به شرح زیر می باشد:
5Fe2+(aq) + MnO4–(aq) + 8H+(aq) → 5Fe3+(aq) + Mn2+(aq) + 4H2O
-
مثال 2:
-
مثال 3:
تفاوت های میان تیتراسیون مستقیم، غیر مستقیم و برگشتی (معکوس)
مستقیم:
در نوع مستقیم ماده ی تیتر شونده به طور مستقیم با تیترانت وارد واکنش می شود ( در بالا به تفسیر راجع به تیتراسیون مستقیم بحث گردید). بنابراین ، نقطه پایانی فرایند نشانگر پایان واکنش است. در نتیجه با استفاده از نقطه پایانی ، می توان مقدار ترکیب ناشناخته موجود در محلول نمونه را تعیین نمود.
غیر مستقیم:
در بعضی مواقع به خصوص زمانی که ماده ی مورد نظر نامحلول و ناپایدار است نمی توان به شیوه ی مستقیم میزان غلظت ماده ی مورد نظر را تعیین نمود. به همین دلیل از روش غیر مستقیم کمک می گیرند. در این فرایند ماده ای که قرار است غلظت آن تعیین گردد با ماده ای دیگری وارد واکنش می شود. ماده ی اصلی رسوب می کند و یا از محلول خارج می شود در نتیجه این ماده خود به طور مستقیم در فرایند تیتراسیون شرکت نخواهد داشت. در فرایند غیر مستقیم مقدار مول های ماده ی جایگزین محاسبه می شود و به مقدار گونه ی مورد نظر مربوط است.
-
مثال:
به عنوان مثال سنگ مرمر حاوی مقادیری کربنات کلسیم می باشد و شما می خواهید این مقدار را تعیین نمایید. برای این منظور سنگ مورد نظر را با ماده ای واکنش می دهیم که با کلسیم کربنات وارد واکنش شود و تمام کربنات موجود را حذف نماید. به عنوان مثال برای این کار از اسید نیتریک استفاده می کنیم. مطمئن شوید که شما دقیقاً می دانید چه مقدار اسید نیتریک در ابتدا اضافه کرده اید.
بخشی از آن اسید با کربنات واکنش نشان می دهد ، و بقیه ی آن باقی می ماند. بنابراین ، اگر می دانید در ابتدا چقدر اسید اضافه کرده اید و می دانید چه مقدار اسید باقی مانده است ، تفاوت آن دقیقاً در میزان اسیدی است که با کربنات واکنش نشان می دهد. در نتیجه مقدار مجهول به راحتی محاسبه می گردد.
مقدار اسید باقی مانده را می توان با تیتراسیون با یک باز مانند NaOH مشخص نمود (تیتراسیون اسید و باز).
معکوس یا برگشتی:
نوع برگشتی یک روش تیتراسیون است که برای تعیین غلظت ناشناخته با استفاده از مقدار اضافی یک ترکیب با غلظت شناخته شده استفاده می شود. یک واکنش شیمیایی بین این ترکیبات وجود دارد. از آنجا که مقدار ترکیب با غلظت افزوده شده در حال حاضر مشخص است ، می توانیم با انجام یک تیتراسیون برعکسی مقدار ترکیبی که با ترکیب ناشناخته واکنش نشان داده است را تعیین کنیم.
به بیان دیگر همانطور که می دانید در تیتراسیون دو مولفه درگیر می باشد “تیترانت” و “تیتر شونده” . تیترانت محلولی با غلظت معلوم است. تیتر شونده آنالیت مورد نظر می باشد. این نمونه، از مواد با غلظت نامشخص تشکیل شده است و با محلول تیترانت وارد واکنش می شود.اما تیتراسیون برگشتی باعث واکنش مستقیم میان تیترانت و تیتر شونده نمی شود.
در ابتدا ما یک ترکیب اضافی به محلول نمونه اضافه می کنیم که منجر به انجام یک واکنش شیمیایی می شود. سپس مقدار باقی مانده را اندازه می گیریم. در ادامه یک مثال می زنیم تا با این فرایند بیشتر آشنا شوید:
-
مثال:
به عنوان مثال ما یک محلول با یون های فلزی (با غلظت نا مشخص) داریم. در این صورت ما می توانیم برای آنالیز محلول از تیتراسیون برگشتی ادتا استفاده نماییم. در ابتدا مقدار اضافی ادتا را به محلول اضافه می نماییم. افزودن ادتا منجر به تشکیل کمپلکس یون فلز-ادتا می شود.
سپس مقدار باقی مانده ی ادتا موجود در نمونه با کمک محلول Mg2+ در حضور شناساگر EBT در طی فرایند تیتراسیون تعیین می شود. از آنجا که از قبل مقدار ادتای افزوده شده مشخص بود ما می توانیم میزان ادتا را که با فلز ناشناخته وارد واکنش شدند تعیین نماییم . در نتیجه با محاسبه میزان فلز موجود مشخص می گردد.
علاوه بر این روش برگشتی می تواند برای تشخیص دقیق نقطه ی پایانی مورد استفاده قرار بگیرد. بعضی اوقات ، به دلیل تغییرات سریع رنگ که در نقطه انتهایی رخ می دهد ، نمی توان نقطه پایانی را بدست آورد. در مواقعی شبیه به آن ، می توان از روش برگشتی برای دستیابی به نقطه پایانی استفاده کرد.
تفاوت های میان روش مستقیم و برگشتی:
- برگشتی: اندازه گیری غلظت ناشناخته ، با استفاده از افزودن مقدار اضافی ای از ترکیب با غلظت شناخته شده
- مستقیم: واکنش میان ترکیب ناشناخته و ترکیب با غلظت مشخص
- در روش برگشتی یک واکنش شیمیایی رخ می دهد
- در روش مستقیم تنها یک واکنش شیمیایی رخ می دهد.
- تیترشونده در روش برگشتی مقدار اضافی ماده ی افزوده شده می باشد ( در مثال بالا ادتا)
- تیتر شونده در روش مستقیم ترکیبی ناشناخته است
این دو روش می توانند از نظر کاربرد نیز متفاوت باشند. روش مستقیم معمولا برای موادی به کار می رود که تغیییر رنگ آن ها در نقطه ی پایانی با چشم قابل مشاهده باشد. در روش معکوس می توان نقطه ی پایانی را با دقت بیشتری، به خصوص برای موادی که تغییر رنگ قابل مشاهده ای در تیتراسیون مستقیم ندارند استفاده نمود.
کاربرد ها
همانطور که پیش از این نیز اشاره گردید تیتراسیون روشی است که در شیمی برای اندازه گیری نسبت مواد شیمیایی موجود در محلول استفاده می شود. این روش به دلیل سادگی و خواص فراوانی که دارد در صنعت به وفور استفاده می شود. در ادامه با کاربرد های آن بیشتر آشنا می شویم:
-
کاربرد های زیست محیطی:
کارشناسان محیط زیست معمولا میزان بارش و آلودگی های موجود در آن را مورد بررسی قرار می دهند. تعیین میزان آلودگی های موجود در هر بارندگی و با برف با کمک تیتراسیون انجام می پذیرد. این روش سریع است و نتایج دقیقی را نشان می دهد.از آنجایی که بیشتر فرآیندهای تیتراسیون به تجهیزات گران قیمت یا تخصصی احتیاج ندارند ، این آزمایش اغلب برای تعیین میزان الودگی های موجود در بارش گزینه ی مناسبی می باشد.
-
آب و فاضلاب:
کیفیت آب به میزان مواد شیمیایی موجود در آن بستگی دارد. با تجزیه و تحلیل آب می توان میزان آلودگی و الزامات تصفیه ی را تعیین نمود. تیتراسیون مکانیسم اصلی در این تجزیه و تحلیل است. در این صنعت از روش های تیتراسیون پیچیده تری استفاده می شود. در ابتدا سطح آمونیاک موجود در ترکیب با سایر واکنش دهنده ها را اندازه گیری می نمایند تا در نهایت مقدار سایر مواد شیمیایی دیگر مشخص گردد.
-
مواد غذایی:
ترکیباتی که محصولات غذایی را تشکیل می دهند در مقدار مغذی بودن آن نقش ویژه ای دارند. روش فوق تکنیکی است که در این مطالعات کمک می کند. به عنوان مثال ، اسیدیته آب پرتقال با استفاده از یک فرایند تیتراسیون استاندارد به راحتی تعیین می شود. در این فرآیند، یک الکترود به محلول متشکل از آب پرتقال و آب دیونیزه اضافه می شود. سپس با کمک تیترانت اسیدیته ی آب پرتقال تعیین می گردد.تولیدکنندگان می توانند از این تکنیک برای بهبود کیفیت و جلب رضایت رضایت مشتری یا کسانی که نیازهای غذایی خاصی دارند استفاده کنند.
-
داروسازی:
ساخت دارو و عرضه ی آن به بازار نیازمند دقت زیادی دارد و به اندازه گیری های خاص مواد شیمیایی موجود در دارو متکی می باشد. بنابراین می توان گفت روش فوق بخش مهمی از صنعت داروسازی را تشکیل می دهد که با کمک آن می توان به کنترل کیفیت دارو های تولیدی پرداخت.
منبع
فروش و خرید مواد شیمیایی را به ما بسپارید.






