
اسید سولفوریک (H2SO4) یک ماده اولیه اساسی است که در طیف وسیعی از فرآیندهای صنعتی و عملیات تولید استفاده می شود. بخش عمده ای از این ماده در تولید کودهای فسفاته استفاده می شود و سایر مصارف شامل شستشوی مس ، تولید رنگدانه های غیر آلی، تصفیه نفت، تولید کاغذ و تولید مواد شیمیایی آلی صنعتی است. در این مقاله فرآیند تولید این اسید به همراه واکنش های دخیل در آن را به صورت کامل برای شما شرح خواهیم داد.
روش تولید صنعتی اسید سولفوریک
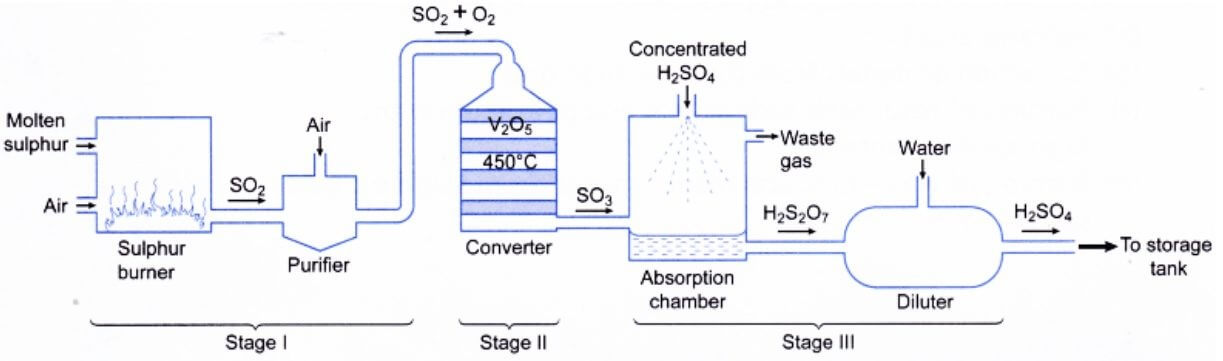
این اسید از گوگرد در یک واکنش سه مرحله ای تولید می شود:
S + O2 → SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
از آنجا که واکنش گوگرد با هوای خشک گرمازا است، دی اکسید گوگرد باید خنک شود تا گرمای اضافی از بین برود و از انفجار واکنش جلوگیری شود.
احتراق عنصر گوگرد منبع غالب دی اکسید گوگرد است که در فرآیند تولید استفاده می شود. از جمله روش های دیگر برای تامین منابع سولفور دی اکسید، می توان به احتراق سولفید هیدروژن حاصل از گازهای زائد، تجزیه حرارتی H2SO4 مصرف شده و یا سایر مواد حاوی گوگرد، و همچنین سوزاندن پیریت ها اشاره کرد.
این ماده خورنده را می توان به صورت تجاری و با روش فرآیند تماس تولید کرد.
فرآیند تماس
در فرآیند تماس، تهیه مواد خام در دستگاه با سه روش صورت می گیرد:
- احتراق گوگرد عنصری
- احتراق سولفوریک اسید و هیدروژن سولفید مصرف شده
- احتراق سنگ فلز گوگرد.
به طور خاص ، فرایند تماس شامل سه عملیات اساسی است، که هر کدام مربوط به یک واکنش شیمیایی مشخص است. ابتدا گوگرد موجود در مواد اولیه به دی اکسید گوگرد اکسید (سوزانده) می شود:
S + O2 → SO2
دی اکسید گوگرد حاصل به کمک کاتالیزور وانادیم پنتا اکسید (V2O5) به تری اکسید گوگرد اکسید می شود. این واکنش برگشت پذیر و بسیار گرمازا است و به جهت کنترل آن به مبدل های حرارتی منتقل می شود تا محصول تولید شده تثبیت شود :
2SO2 + O2 → 2SO3
در مرحله نهایی سولفور تری اکسید 97-98% H2SO4 را جذب می کند و الئوم (H2S2O7) را که به بخور سولفوریک اسید نیز مشهور است، تولید می کند. الئوم تولید شده با آب رقیق می شود و اسید غلیظ را تولید می کند.
H2SO4 + SO3 → H2S2O7
H2S2O7 + H2O → 2 H2SO4
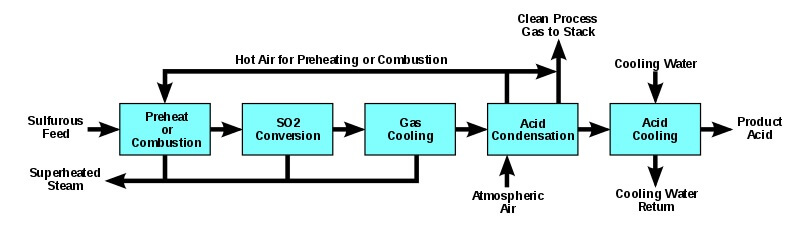
سیستم فرآیند احتراق را می توانید در شکل زیر مشاهده فرمایید.
جهت خرید اسید فسفریک کلیک کنید.
فرآیند Frasch
در این فرآیند، ابتدا عنصر گوگرد ذوب شده، و برای جداسازی خاکستر از آن، فیلتر می شود. سپس تحت فشار به درون یک محفظه احتراق اسپری می شود تا سولفور در هوای تمیزی که با سولفوریک اسید 93%-99% خشک شده است، سوزانده شود. گازهای محفظه احتراق با عبور از دیگ بخار خنک شده و سپس وارد مبدل کاتالیست (پنتا اکسید وانادیوم، V2O5) می شوند. به طور معمول، 95 تا 98 درصد (v/v) دی اکسید گوگرد از محفظه احتراق، با کمک گرما، به تری اکسید گوگرد تبدیل می شود.
پس از خنک شدن، دوباره با تولید بخار، گاز خروجی مبدل وارد یک برج جذب می شود. برج جذب یک ستون بسته بندی شده است که در آن اسید در قسمت بالا پاشیده می شود و تری اکسید گوگرد از پایین وارد می شود. تری اکسید گوگرد در H2SO4 98-99 (v/v) جذب می شود که در آن تری اکسید گوگرد با آب موجود در اسید ترکیب شده و H2SO4 بیشتری تشکیل می دهد. اگر اولئوم تولید شود ، تری اکسید گوگرد از مبدل ابتدا به یک برج اولئوم منتقل می شود که با 98 درصد اسید از سیستم جذب تغذیه می شود.
سپس گازهای برج اولئوم به ستون جذب در جایی که تری اکسید گوگرد باقیمانده خارج می شود ، پمپ می شوند. در فرآیند جذب منفرد فقط از یک جاذب استفاده می شود همانطور که از نام آن پیداست، اما بسیاری از دستگاه ها بخش جذب دوگانه را نصب کرده اند.
در بخش جذب دوگانه، گاز تری اکسید گوگرد تشکیل شده در مبدل اولیه به یک جاذب میانی فرستاده می شود که در آن بیشتر تری اکسید گوگرد خارج می شود و اسید سولفوریک تشکیل می شود. دی اکسید گوگردی که واکنش نداده به بخش نهایی مبدل جهت حذف دی اکسید گوگرد و تبدیل آن به گوگرد تری اکسید منتقل می شود. اگر اولئوم تولید شود، گوگرد تری اکسید از مبدل به ستون اولئوم که با اسید 98% از جاذب ها تغذیه می شود منتقل می شود. گازهای این برج سپس به ستون جذب در جایی که تری اکسید گوگرد خارج می شود ، پمپ می شوند. غلظت های مختلفی از اولئوم را می توان تولید کرد که به صورت 20% (20% حجمی گوگرد تری اکسید و 80% حجمی H2SO4، بدون آب)، 40% و 60% است.
تولید اسید سولفوریک به روش مرطوب
فرآیند مرطوب (فرآیند WSA) یکی از مهمترین فرآیندهای گوگرد زدایی گاز در بازار امروز است. اولین بار این روش توسط یک شرکت دانمارکی در سال 1980 معرفی شد که یک روش کارآمد جهت بازیافت گوگرد از گازهای مختلف در تولید صنعتی با فشار بخار بالا است. فرآیند WSA در کلیه صنایعی که حذف گوگرد یک مشکل است مورد استفاده قرار می گیرد.
در مرحله اول، گوگرد سوزانده می شود و به گوگرد دی اکسید تبدیل می شود:
S + O → SO2
و یا هیدروژن سولفید با اکسیژن سوزانده می شود و گاز گوگرد دی اکسید تولید می شود:
2 H2S + 3 O2 → 2 H2O + 2 SO2
در ادامه گوگرد دی اکسید با کمک کاتالیزور وانادیم اکسید با اکسیژن سوزانده می شود و به گوگرد تری اکسید تبدیل می شود. این واکنش تعادلی و برگشت پذیر است:
2 SO2 + O2 → 2 SO3
در نهایت گوگرد تری اکسید هیدراته شده و به سولفوریک اسید گازی تبدیل می شود:
SO3 + H2O → H2SO4
در مرحله آخر اسید گازی متراکم شده و به مایعی با غلظت 07-98 درصد تبدیل می شود.
لیست شرکت های تولید کننده اسید سولفوریک در ایران
با توجه به اهمیت این ماده در صنعت، امروزه کارخانجات بسیاری در زمینه تولید و صادرات این محصول فعالیت می کند. از جمله آن ها می توان به موارد زیر اشاره کرد:
- کارخانجات مس سرچشمه
- کارخانجات زرین مهد شیمی سمنان
- شرکت اسید سازان زنجان
- شرکت جهان قیر پارس اصفهان
- ماهان شیمی آیریک اصفهان
- شرکت پترو آکام راد
در این میان بهترین محصول مربوط به اصفهان و سمنان بوده که علت کیفیت و خلوص بالای آن است. حدود 7 درصد اسید تولید شده صادر می شود که علت آن خورندگی بالای این ترکیب است.

باسلام وتشکر از مقاله تان مفید بود واستفاده کردم موفق باشید.
سلام، از توجه شما سپاسگزاریم.
بسیار عالی سپاس بابت توضیحات کامل.
از توجه شما سپاسگزایم.