
فنول (phenol) ترکیبی بسیار کاربردی و اقتصادی است که در بسیاری از صنایع از پللاستیک و رزین گرفته تا صنایع دارویی و آرایشی بهداشتی کاربرد بسیار زیادی دارد. جهت ثبت سفارش و اطلاع از قیمت فنول با واحد فروش مبتکران شیمی تماس بگیرید.
فروش فنول:
شما می توانید برای تهیه ی این ماده ی شیمیایی و یا سایر مواد شیمیایی مورد نظرتان با ما در مبتکران شیمی تماس حاصل فرمایید.
خرید فنول:
خرید این ماده با بهترین کیفیت را به ما بسپارید و خریدی مطمئن را تجربه نمایید.
| اطلاعات محصول |
تولید کننده: چین CAS NO:108-95-2 |
| آنالیز محصول |
خواص و ویژگی ها
فنول که با نام های کربولیک اسید و هیدروکسی بنزن نیز شناخته می شود ، پایه دسته ای از ترکیبات است که در آن ها گروهی هیدروکسیل به صورت مستقیم به یک حلقه آروماتیک پیوند خورده است. فنول یا اختصارا PhOH به دلیل وجود OH به خانواده الکل ها تعلق دارد . گروه هیدروکسیل به این ماده خاصیت اسیدی می دهد در حالی که گروه بنزن خاصیت اسیدی آن را تعیین می کند.
این محصول دمای ذوب پایینی دارد و به صورت بلورهای بی رنگ کریستالیزه می شود ، دارای بویی مشخص و کمی تند است. در حالت مذاب نیز مایعی روشن ، بی رنگ و متحرک است.
در اکثر حلال های آلی (هیدروکربن های آروماتیک ، الکل ها، کتون ها، اترها، اسیدها ، کربن های هالوژنه و …) به سرعت حل می شود و حلالیت آن در هیدروکربن های آلیفاتیک مقداری کمتر است. فنل قابلیت تشکیل مخلوط های آزئوتروپیک با آب و سایر ترکیبات را دارد.
خواص فیزیکی و شیمیایی
| فرمول شیمیایی | C6H6O |
| جرم مولکولی | 94.11 g/mol |
| نقطه جوش | 181.8 °C |
| دمای ذوب | 40.9 °C |
| حلالیت در آب | 82.8 mg/mL at 25 °C ، از دمای 65.3 °C به بالا با آب در تمامی مقادیر قابل امتزاج هستند. |
| چگالی | 1.06 g/cm³ |
تاریخچه کشف
فنول یکی از اجزای سازنده قطران زغال سنگ است و احتمالا برای اولین بار توسط Runge در سال 1834 از قطران زغال سنگ بدست آمد و آن را کربولیک اسید نامید. فرم خالص آن برای اولین بار توسط Laurent در سال 1841 بدست آمد. دمای ذوب (بین 34-35 درجه سانتی گراد ) و دمای جوش ( بین 187 و 188 درجه سانتی گراد) ارائه شده توسط او به آنچه که امروزه می دانیم نزدیک بود. علاوه بر خواص فیزیکی و ظاهری ، Laurent مقداری از کریستال های این ماده را به افرادی که دچار دندان درد بودند داد تا خواص احتمالی تسکین دهندگی آن را آزمایش کند که البته تاثیر آن نامشخص بود ، ولی متوجه شد که فنول تاثیری شدید بر روی لب ها دارد.
در 1843 Charles Frederic Gerhardt این ترکیب را از طریق حرارت دادن سالیسیلیک اسید به همراه آهک تولید کرد. در 1867 فرآیند Raschig–Dow که فنول را با استفاده از کیومن تولید می کرد توسط Wurtz و Kekule کشف شد.
فنول می تواند به عنوان یک جزء و یا یک محصول اضافی در بسیاری از محصولات و مکانیسم های طبیعی وجود داشته باشد. به عنوان مثال جزئی از لگینین است که از طریق هیدرولیز آزاد می شود.
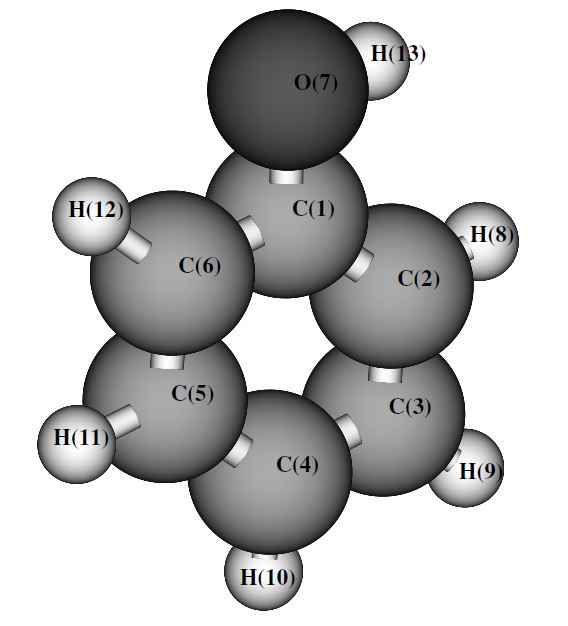
مشتقات
- یکی از مشتقات مهم و شناخته شده این ترکیب فنول فتالئین است که از واکنش فنل با فتالیک آنهیدرید در حضور اسید سولفوریک تولید می شود.
- یکی از راه های کم کردن خطرات و سمیت این ماده کلر دار کردن آن است . در این فرایند گاز کلر با فنول واکنش داده و یک ، دو و یا سه اتم کلر به مولکول اضافه می شود. به طور کلی 31 ترکیب مختلف کلر و پلی کلروفنولی وجود دارد. یک از آن ها با نام 2و4 دی کلروفنوکسیاستیک اسید به عنوان هورمون رشد در گیاهان عمل می کند.
- فنول ها دسته ای بسیار مهم از آنتی اکسیدان ها هستند که استفاده از آن ها در تمام موجودات زنده و ترکیبات آلی موجب کاهش اکسیداسیون ناشی از قرار گرفتن در معرض هوا می گردد.
- ترکیبات فنولیک همچنین برای متوقف کردن پری اکسیداسیون لیپید در ارگانیسم های زنده استفاده می شوند . به همین دلیل به صورت گسترده به عنوان افزودنی در صنایع غذایی کاربرد دارند.
تولید
هرچند که فنول می تواند به صورت طبیعی و یا به عنوان محصول جانبی در برخی از فرآیندها وجود داشته باشد ، اما این مقدار اندک است و برای پاسخگویی به تقاضای بازار روش های سنتزی ترجیح داده می شوند . یکی از روش های محبوب برای سنتز استفاده از بنزن است . در حدود 20% بنزن تولیدی در جهان برای تولید فنول مورد استفاده قرار می گیرد.
امروزه عموما فنول با استفاده از کیومن (ایزوپروپیل بنزن ، 2- فنیل پروپان) تولید می شود. کیومن مایعی بی رنگ ، دارای بویی معطر و آتشگیر است.
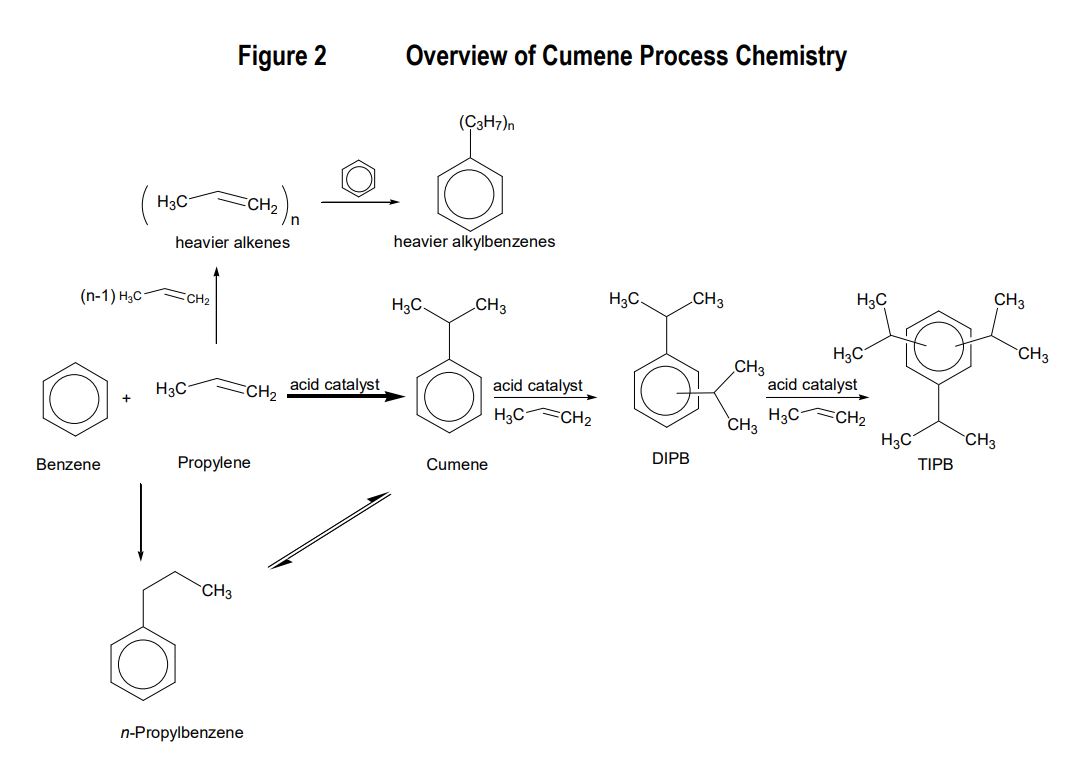
تقریبا تمام کیومن تولید شده تجاری با استفاده از آلکیلاسیون کاتالیستی بنزن با استفاده از پروپیلن انجام می گیرد. واکنش بین پروپیلن و بنزن تحت مکانیسم فریدل-کرافت صورت می گیرد. کاتالیست های اسیدی مختلفی مانند آلومینیوم کلراید (AlCl3) ، اسید فسفریک جامد و زئولیت های اسیدی در عملیات های تجاری مورد استفاده قرار می گیرند. در واحدهای جدیدتر عموما از زئولیت ها استفاده می شود.
فرآیند تبدیل کیومن به فنول در مقیاس تجاری شامل دو مرحله است که عبارتند از : اکسیداسیون کیومن به کیومن هیدروپراکسید (CHP) و تبدیل کاتالیستی CHP به فنول و استون. با این حال واکنش های جانبی زیادی اتفاق می افتند که منجر به تولید محصولات جانبی خواهد شد.
این واحد شامل 7 مرحله زیر است :
- اکسیداسیون کیومن به CHP
- تغلیظ CHP
- تجزیه CHP به محصولات
- خنثی سازی
- تصفیه گاز
- تغلیظ و بازگردانی فنول و استون
- هیدروژناسیون آلفا-متیل استایرن به کیومن
مراحل اکسیداسیون ، تجزیه (Cleavage) و تغلیظ محصولات از لحاظ اقتصادی و امنیتی مهمترین مراحل این فرآیند هستند.
کاربردها
این ترکیب اولین بار در سال 1865 توسط یک جراح در دانشگاه گلاسکو اسکاتلند برای استریل کردن زخم ها، پانسمان ها و ابزار جراحی مورد استفاده قرار گرفت. او نشان داد که اگر از فنل برای استریل کردن تجهیزات و پانسمان ها استفاده شود، عفونت زخمی کمتری وجود خواهد داشت و در نتیجه بیماران شانس بیشتری برای زنده ماندن خواهند داشت. 47 سال پس از مرگ این پزشک ، روش او به عنوان روشی عمومی برای جراحی پذیرفته و بکار گرفته می شد. همین عامل باعث شد تا phenol در بسیاری از مواد خانگی مانند صابون ها استفاده شود. اما بعدها معلوم شد که می تواند خطراتی بسیار جدی برای سلامتی انسان داشته باشد ، از همین رو امروزه استفاده از آن در محصولات خانگی ممنوع است.
تقریبا دو سوم از کل فنول تولید شده برای تولید موادی که در صنعت پلاستیک مورد استفاده قرار می گیرند ، مصرف می شود. واکنش استون و فنول باعث تولید بیسفنول A می شود که به صورت گسترده ای در صنعت پلیمر برای تولید رزین های اپوکسی و پلی کربنات ها به کار برده می شود.
واکنش پلیمریزاسیون با فرمالدهید برای تولید تجاری رزین های فنولیک کاربرد دارد که محصول نهایی آن رزین فنول-فرمالدهید است که با نام تجاری باکیلیت شناخته می شود. باکیلیت به دلیل مقاومت خوب در برابر گرما ، الکتریسیته و مواد شیمیایی به صورت گسترده در وسایل الکتریکی و ماشین کاربرد دارد.
در زیست شناسی مولکولی از فنول برای استخراج اسیدهای نوکلئیک از بافت های نمونه در کارهای تحقیقاتی استفاده می شود.
همچنین این ماده در صنایع آرایشی بهداشتی در تولید ضدآفتاب ها ، کرم های روشن کننده پوست و محلول های رنگ مو کاربرد دارد.
منابع
Rappoport, Z. (2004). The chemistry of phenols. John Wiley & Sons.
Admin. (2019, July 30). Phenol – Uses Of Phenol, The Phenolic Resins And Their Applications. Retrieved December 15, 2019, from https://byjus.com/chemistry/uses-of-phenol.
Phenol. (n.d.). Retrieved from https://pubchem.ncbi.nlm.nih.gov/compound/Phenol.
محصولات مرتبط:

