
شناساگر ها عواملی هستند که با کمک آن ها می توان به شناسایی گونه ی مورد نظر پرداخت.
به طور کلی این شناساگر ها را به سه نوع اساسی تقسیم بندی می نمایند:
1-کاهشی: این مواد در تیتراسیون های اکسایش-کاهش مورد استفاده قرار می گیرند.
2-کمپلکسومتری: برای اندازه گیری کاتیون های فلزی مورد استفاده قرار می گیرند.
3-pH: .یکی از پر کاربرد ترین موارد استفاده از این شناساگر ها استفاده از آن ها در تعیین نقطه ی اکی والان تیتراسیون اسید و باز در حین عبور از محیط های اسیدی و یا بازی با کمک تغییر رنگ این مواد می باشد.
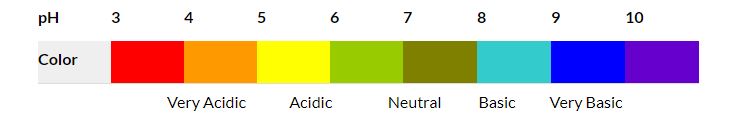
شناساگر های pH انواع گوناگونی دارند و در رنگ های مختلف مشاهده می گردند. عاملی که بین همه ی این مواد مشترک می باشد ، غیر یکنواخت بودن رنگ این مواد در محیط های اسیدی و بازی است.
در ادامه با انواع این شناساگر های (indicators) پی اچ و تغییرات رنگی آن ها در محیط های اسیدی و بازی بیشتر آشنا می شویم.
 شناساگر PH چیست؟
شناساگر PH چیست؟
شناساگر pH یک شاخص اسیدی و یا بازی می باشد که رنگ محلول را در دامنه ی مشخصی از pH تغییر می دهد. مقدار اندکی از این مواد برای دیده شدن تغییر رنگ محیط واکنش کافی می باشد. این مواد رقیق می باشند و به طور مشخص بر روی pH واکنش تاثیری نمی گذارند.
شاخص های پی اچ به صورت مایع و یا کاغذی موجود می باشند. فرم مایع این شناساگر ها به محلول مورد سنجش افزوده می شود در حالی که فرم کاغذی آن درون محلول چند ثانیه ای نگه داشته می شود و سپس با راهنمای رنگی موجود مقایسه می گردد تا از تغییر رنگ مشاهده شده در کاغذ بتوان مقدار پی اچ را به صورت تقریبی اندازه گیری نمود.
در نهایت مقدار پی اچ نشان می دهد که چه مقدار H+ از مولکول موجود در محلول جدا شده است.
پی اچ حدود 7 نشان دهنده ی محلولی خنثی مانند آب می باشد.
pH بالا تر از 7 نشان دهنده ی محلول بازی، و پایین تر از 7 پی اچ اسیدی را نشان می دهد.
 اساس کار
اساس کار
مقدار پی اچ واکنش همانطور که می دانید به غلظت یون هیدرونیوم موجود در واکنش وابسته می باشد و با منفی لگاریتم +H3O می توان مقدار پی اچ واکنش را محاسبه نمود.
اساس کار این شناساگر ها نیز بر پایه ی واکنششان با آب و تشکیل یون هیدرونیوم +H3O و یا همان هیدروژن کاتیونی +H می باشد. بعضی از این شناساگر ها از یک رنگ به رنگ دیگر تغییر پیدا می کنند اما در بعضی دیگر شاهد تغییر رنگ محلول از بی رنگ به رنگی شدن و یا بالعکس توسط این شناساگر ها خواهیم بود.
این مواد جز اسید ها و یا باز های ضعیف دسته بندی می گردند و به صورت طبیعی یافت می شوند. به طور مثال آنتوسیانین های موجود در گلها، میوه ها و یا سبزیجات جز شناساگر های pH به حساب می آیند. از جمله گیاهانی که شامل آنتوسیانین ها می باشند می توان به کلم قرمز، بلوبری، زغال اخته، گیلاس،توت فرنگی و…. اشاره نمود. از جمله ی دیگر شناساگر های طبیعی نیز می توان به لیتموس، که از ترکیب گل سنگ به دست می آید نیز اشاره کرد.
برای یک اسید ضعیف با فرمول HIn واکنش تعادلی زیر برقرار است:
طبق اصل لوشاتلیه، در pH های پایین (اسید های قوی) غلظت یون هیدرونیوم بالا است و موقعیت تعادل به سمت چپ می باشد. در نتیجه محلول به رنگ گونه ی HIn دیده می شود. در pH های بالا غلظت یون هیدرونیوم کم است ، در نتیجه جهت واکنش به سمت راست می باشد و محلول دارای رنگ گونه ی بازی –In است.
نکته:
لازم است توجه داشته باشید که مقدار pH واکنش رابطه ای لگاریتمی با مقدار یون هیدرونیوم موجود دارد در نتیجه افزایش 1 واحد پی اچ می تواند منجر به افزایش ده برابری غلظت یون هیدرونیوم شود.
 انواع شناساگر ها:
انواع شناساگر ها:
متیل قرمز:
برای تعیین مقادیر pH بین 4.4 تا 6.2 مورد استفاده قرار می گیرد. در pH های پایین( 4.4 و پایین تر) رنگ محلول به رنگ قرمز می باشد. در pH ها ی بالا (6.2 و یا بالاتر) رنگ محلول زرد می باشد. در بین دامنه ی پی اچ 4.4 الی 6.2 رنگ محلول نارنجی است.
بروموکروزول سبز:
بروموکروزول سبز نیز عاملی برای شناسایی pH محیط می باشد و برای تعیین مقادیر بین 3.8 تا 5.4 مورد استفاده قرار می گیرد. در pH های پایین تر از 3.8 محلول مورد نظر زرد خواهد بود . در pH=5.4 و یا بالاتر محلول آبی می باشد. در pH بین این دو مقدار محلول به رنگ سبز مشاهده خواهد شد.
فنل فتالئین:
این ماده برای تعیین مقادیری ما بین پی اچ 8 الی 10 مورد استفاده قرار می گیرد. این ماده در محیط های اسیدی بی رنگ می باشد و در محلول های قلیایی به رنگ ارغوانی تغییر رنگ می دهد.
متیل نارنجی (متیل اورنژ):
شناساگر متیل اورنژ در محیط های اسیدی قرمز مایل به نارنجی و در محیط های بازی به رنگ زرد تغییر رنگ می دهد.
در شکل زیر می توانید تغییر رنگ متیل اورنژ را در دو محیط اسیدی و بازی مشاهده نمایید.
متیلن بلو:
متیلن بلو یکی از شناساگر های مهمی است که در واکنش های اکسایش کاهش مورد استفاده قرار می گیرد. متیلن بلو آبی رنگ می باشد و در صورتی که در واکنش شاهد عملیات احیا باشیم این شناساگر به سمت بی رنگ شدن تغییر رنگ می دهد. در صورتی که در واکنش مجددا عملیات اکسید شدن روی دهد، متیلن بلو مجددا می تواند به رنگ آبی تغییر رنگ داشته باشد. از دیگر شناساگر های اکسایشی –کاهشی می توان به ایندیگو کرمین، دی فنیل آمین، کلروفنول قرمز و… اشاره نمود.
کاغذ لیتموس:
این ماده در دو رنگ آبی و قرمز موجود می باشد، لیتموس آبی در محیط اسیدی به رنگ قرمز تغییر رنگ می دهد و لیتموس قرمز زمانی که به رنگ آبی تغییر پیدا کند نشان دهنده ی بازی بودن محلول واکنش است.
در شکل زیر می توانید تغییر رنگ موجود در کاغذ لیتموس را بعد از فرو بردن آن در محلول شوینده(بازی) و در آبلیمو (محلول اسیدی) مشاهده نمایید:
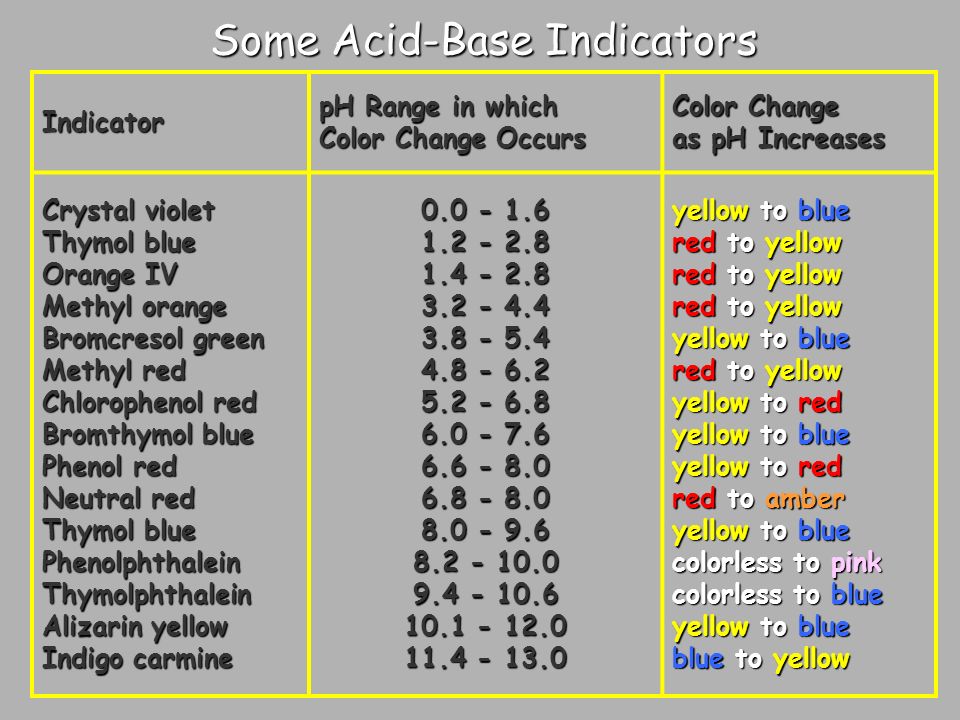
در جدول زیر می توانید سایر شناساگر ها و تغییرات موجود در دامنه های پی اچ آن ها را مشاهده نمایید:
 شناساگر جهانی
شناساگر جهانی
از آنجایی که شناساگر ها رنج های به خصوصی از pH را شناسایی می کنند و نسبت به تغییر رنگ در آن دامنه حساس می باشند، در نتیجه می توان با اختلاط شناساگر ها محدوده ی وسیع تری از pH را به وجود آورد که به آن شناساگر جهانی می گویند.
برای مثال با ترکیب شناساگر هایی مانند تیمول آبی، متیل قرمز، برموتیمول آبی و فنل فتالئین می توان شناساگری عمومی با دامنه ی pH کمتر از 3 (قرمز) و بالاتر از 11 (بنفش) به وجود آورد. رنگ های ما بین این دو pH عبارتند از نارنجی/زرد (پی اچ 3 تا 6) ، سبز (پی اچ 7 یا خنثی) ، آبی (پی اچ 8 تا 11). شناساگر های جهانی معمولا به صورت کاغذی موجود می باشند. تفاوت شناساگر جهانی با کاغذ لیتموس در این است که با کمک شناساگر های جهانی می توان به طور تقریبی pH واکنش را با کمک چارت راهنمای موجود پیدا نمود اما کاغذ لیتموس تنها می تواند اسیدی و یا بازی بودن محیط واکنش را تعیین نماید.
 روش های دیگر تعیین pH
روش های دیگر تعیین pH
شناساگر های pH برای به دست آوردن تقریبی pH یک محلول شیمیایی مورد استفاده قرار می گیرد. برای اندازه گیری های دقیق تر از pH متر استفاده می کنند.با کمک اسپکتروسکوپی جذب نیز می توان با استفاده از شناساگر های pH و با کمک قانون بیر لامبرت به محاسبه ی pH پرداخت.
 طراحی آزمایش برای آشنایی بیشتر با تغییر رنگ شناساگرها
طراحی آزمایش برای آشنایی بیشتر با تغییر رنگ شناساگرها
کلم قرمز یک شناساگر طبیعی به حساب می آید که در محیط اسیدی از رنگ بنفش به قرمز تغییر رنگ می دهد و در محیط بازی شاهد تغییر رنگ آن از بنفش به سبز خواهیم بود.
در ادامه به طراحی آزمایشی برای آشنایی با خاصیت این شناساگر طبیعی می پردازیم.
مواد لازم:
- کلم قرمز
- قابلمه یا مخلوط کن
- کاغذ صافی
- آمونیاک
- سرکه (اسید استیک)
- آب
- کاسه
روش کار:
- برگ های کلم را درون قابلمه قرار دهید و بر روی آن آب بریزید تا مطمئن شوید تمام کلم ها با آب پوشش داده شده اند.
- 30 الی 35 دقیقه قابلمه ی حاوی کلم ها را با شعله ی ملایم بجوشانید. اجازه دهید کلم ها خنک شوند و آن ها را به خوبی از صافی عبور دهید.(می توانید به جای گذراندن مرحله ی 1 و 2 ، کلم ها را همراه با آب در مخلوط کن بریزید و با کمک همزن هم بزنید تا یکنواخت شود.)
- آب کلم را به دو قسمت تقسیم می نماییم، به یک ظرف سرکه می افزاییم و به ظرف دیگر آمونیاک را اضافه می کنیم.
نتیجه:
همانطور که مشاهده می شود تغییر رنگ آب کلم در ظرفی که حاوی سرکه می باشد (محلول اسیدی) به رنگ قرمز می باشد.
در ظرفی که حاوی آمونیاک (محلول بازی) می باشد تغییر رنگ محلول از بنفش به سبز خواهد بود.


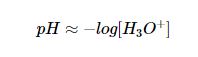
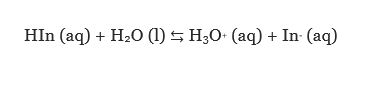








عالی