توضیحات
هیدرازین (Hydrazine) ماده ای بی رنگ با فرمول شیمیایی H6N2O است. به عنوان عامل کاهش دهنده در سنتز بسیاری از واکنش ها و به عنوان حلال برای بسیاری از ترکیبات معدنی استفاده می شود. هیدرازین همراه با متانول به عنوان پیشران در موتور موشک مورد استفاده قرار می گیرد. ترکیب فوق می تواند موجب تجزیه ی کاتالیزوری هیدروژن پراکسید نیز شود. این ترکیب در سنتز بسیاری از مواد شیمیایی، تصفیه ی آب، سوخت موشک، ساخت دارو و غیره کاربرد دارد.
در ادامه ی متن با ما همراه باشید تا با این ترکیب بیشتر آشنا شوید.
هیدرازین چیست؟
هیدرازین (Hydrazine) ترکیبی معدنی با فرمول شیمیایی H6N2O است. این ماده ترکیبی بی رنگ، قابل اشتعال با بویی شبیه به آمونیاک است. نوع بی آب آن، سمیت بالایی دارد. هیدرازین به عنوان عامل کاهش دهنده در سنتز بسیاری از واکنش ها به عنوان حلال کاربرد دارد.
ساختار شیمیایی هیدرازین را در زیر می توانید مشاهده نمایید:
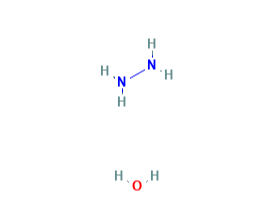
خرید هیدرازین هیدرات:
شما می توانید جهت اطلاع از قیمت هیدرازین و هم چنین سایر محصولات شیمیایی با مشاوران ما در موسسه ی مبتکران شیمی فعال در زمینه ی تامین مواد شیمیایی در ارتباط باشید.
| اطلاعات محصول | تولید کننده: چین
CAS NO: 302-01-2 |
| آنالیز محصول |
فروش هیدرازین هیدرات :
در حال حاضر موسسه ی مبتکران شیمی به عنوان یکی از تامین کنندگان محصولات شیمیایی کشور, طیف گسترده ای از مواد شیمیایی آزمایشگاهی و صنعتی را از برندهای معتبر در اختیار تولید کنندگان قرار می دهد. برای کسب اطلاعات بیشتر می توانید با همکاران ما در ارتباط باشید.
خواص و ویژگی های هیدرازین هیدراته
| فرمول شیمیایی | H6N2O |
| جرم مولکولی | 32.04 g/mol |
| نقطه ی ذوب | −51.7 درجه سانتی گراد |
| نقطه ی جوش | 120.1 درجه سانتی گراد |
| دانسیته | 1.03 g/mL at 20 °C |
لازم به ذکر است که این ماده در آب محلول می باشد. ساختار لوئیس هیدرازین در شکل زیر نشان داده شده است:
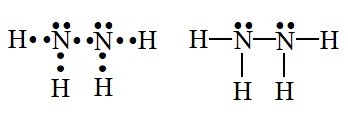
تجزیه هیدرازین:
این ترکیب از 4 اتم هیدروژن و 2 اتم نیتروژن ساخته شده است. نوع بدون آب هیدرازین بسیار سمی است و می تواند منجر به تشنج و یا ایجاد تومور در مغز نیز شود. خاصیت کاهندگی این ماده آنقدر قوی است که می تواند منجر به انفجار گردد. اما هیدرازین به سرعت در اکسیژن تجزیه می شود و انتشار آن در محیط کم خطر است. حتی می تواند یک سوخت سازگار با محیط زیست باشد. در برخی از انواع پیل سوختی هیدروژنی، هیدرازین تجزیه می شود و نیتروژن و آب می سازد و در یک واکنش گرمازا انرژی تولید می کند.
N2H4 (aq) + O2 (g) → N2 (g) + 2H2O
تجزیه انتخابی و کاتالیزوری هیدرازین می تواند یک روش اقتصادی و زیست محیطی موثر برای تولید گاز هیدروژن ارائه دهد که می تواند برای بسیاری از کاربردهای انرژی و سوخت استفاده شود. در حال حاضر، بسیاری از سیستم های کاتالیزور مختلف برای تجزیه هیدرازین وجود دارد.
این ماده سالیانه حدود 100.000 تن در سال تولید می گردد و در صنایع غذایی، پوشاک، سوخت ها تاثیر زیادی دارد.
اما چگونه مولکول به این سادگی این همه کاربرد دارد؟
بیشترین کاربرد این ماده در تهیه ی عامل فومینگ و ساخت آزودی کربن آمید می باشد. هنگامی که آزودی کربن آمید در مایع پیشران پلیمری شروع به تولید حباب می کند به نیتروژن، کربن دی اکسید، مونوکسید کربن و آمونیاک تجزیه می شود. با پلیمریزه نمودن این گاز ها می توان فوم های سبک پلاستیک تهیه نمود. این مواد در ساخت پنل های عایق و تهیه ی ظروف یکبار مصرف مورد استفاده قرار می گیرند.
این ترکیب با این که مستقیما برای انسان خطرناک می باشد اما می تواند در تهیه ی سموم دفع آفات و ساخت مواد دارویی بسار مفید واقع شود. ترکیب فوق به سرعت به اکسیژن تجزیه می شود و خسارت زیست محیطی اندکی به همراه دارد.
همچنین این محصول می تواند یک سوخت دوستدار محیط زیست نیز باشد. در بعضی از انواع سلول های سوختی هیدروژن،هیدرازین شکسته می شود تا نیتروژن و آب تولید شود و انرژی در یک واکنش گرمازا آزاد شود. این فرایند نسبت به هیدروژن انرژی بیشتری تولید می کند و برای ذخیره سازی آسانتر می باشد. در این فرایند مایع در دمای اتاق قرار دارد و نیاز به کاتالیست گران قیمت پلاتین نیست. با این وجود مقدار بیشتری از این ترکیب برای تولید سوخت نیاز می باشد. این ماده در سوخت های فسیلی و نیروگاه های هسته ای نیز وجود دارد و به عنوان یک عامل کاهنده ی قوی موجب مهار نمودن اکسیژن ، کاهش اکسید های فلزی و کند نمودن فرایند خوردگی می شود. علاوه بر این ماهیت انفجاری این ترکیب سبب شده است تا سدیم آزید به دست آمده از آن در تولید ایربگ خودرو ها مورد استفاده قرار بگیرد. سدیم آزید مستقیماً از هیدرازین و نیترات سدیم تولید می شود.
تولید هیدرازین
به صورت تجاری این ترکیب به سه روش تولید می گردد:
- فرایند راشینگ
- کتازین
- فرایند پراکسید
راشینگ:
در فرایند اول یا همان فرایند راشینگ کهRaschig process اصلی ترین روش تولید هیدرازین تجاری می باشد آمونیاک با کلر آمین و هیپوکلریت سدیم اکسید می شود. سپس کلر آمین با سدیم هیدروکسید و آمونیاک اضافی موجود وارد واکنش می شود و محلول آبی هیدروزین یا همان هیدرازین هیدرات تولید می گردد. در طی این واکنش سدیم کلرید به عنوان محصول فرعی تولید می گردد.
با کمک تقطیر نیز خلوص محصول تولیدی را بهبود می بخشند.
کتازین:
امروزه هیدرازین بیشتر با کمک روش کتازین که نوعی روش راشینگ به حساب می آید تولید می گردد.
در این فرایند آمونیاک با کلر و یا کلروامین و در حضور یک کتون آلیافاتیک ( به طور معمول استون) اکسید می شود. سپس کتازین تولید شده به هیدرازین هیدرولیز می شود.
پراکسید:
در فرایند پر اکسید هیدروژن پراکسید برای اکسید نمودن آمونیاک در حضور کتون مورد استفاده قرار می گیرد.
این ماده با غلظت های زیر موجود می باشد:
Hydrazine %100 : عامل فعال کننده در سنتز ها و عامل اصلی تشکیل دهنده ی محصلات و مشتق های هیدرازین هیدرات، همچنین این ماده در غلظت بالا به عنوان عامل کاهش دهنده در تهیه ی دارو ها مورد استفاده قرار می گیرد.
هیدرازین 80 درصد: عامل حد واسط در سنتز ها
هیدرازین 55 درصد: مهار کننده ی خوردگی در بویلر ها (دیگ بخار)
Hydrazine %24: آغاز گر پلیمریزاسیون در فرایند تصفیه ی آب بویلر ها

پایداری هیدرازین:
این ماده با موادی از جمله مواد اکسید کننده، اکسید فلزات سنگین، فلزات قلیایی، نمک نقره و… ناسازگار می باشد. امکان اشتعال این ماده در برخورد با سایر ترکیبات شیمیایی بسیار بالا است و ممکن است با مواد متنوعی از جمله مواد جاذب رطوبت، اکسید فلزات سنگین و پرکلرات ها به طور انفجاری واکنش نشان دهد.
برخورد این ترکیب با کادمیوم، طلا، برنج، مولیبدن و فولاد ضد زنگ حاوی بیش از 0.5 درصد مولیبدن ممکن است باعث تجزیه ی شیمیایی ترکیب شود.
علاوه بر این بخارات این ترکیب نیز می توانند منجر به پدید آمدن آتش شوند. حتما پیش از استفاده از این ترکیب برگه ی ایمنی محصول را مطالعه نمایید.
مقایسه پایداری هیدرازین و آمونیاک
آمونیاک پایدارتر از هیدرازین است زیرا،اگر به یکی از اتم های نیتروژن موجود در هیدرازین نگاه کنیم، به 2 اتم هیدروژن و یک گروه NH2 پیوند دارد نسبت به NH2 که یک گروه الکترون خارج میکند. هرچه سطح انرژی پایین تر ماده پایدار تر و آمونیاک به دلیل پایین بودن سطح انرژی در مقایسه با هیدرازین پایدار تر است.
کاربرد های هیدرازین
در اواخر دهه 1950 الی 1960 استفاده ی اولیه از این ترکیب به عنوان سوخت ماهواره بود . سال 1964 حدود 73 درصد از بازار مصرفی این ترکیب در ایالت متحده ی آمریکا برای سوخت های ماهواره مورد استفاده قرار گرفت. اوایل سال 1982 سایر کاربرد های این ماده بیشتر مورد توجه قرار گرفتند تا جایی که 40 درصد از مصرف این ماده صرف کاربرد در تولید مواد شیمیایی کشاورزی،33 درصد عامل پف کننده، 15 درصد مهار کننده ی خوردگی در بویلر ها و تنها 5 درصد به عنوان سوخت ماهواره ها استفاده گردید.
این ماده در موارد زیر مورد استفاده قرار می گیرد:
- به عنوان یک حد واسط در سنتز مواد آلی (مواد شیمیایی، مواد دارویی و…)
- معرف آزمایشگاهی
- عامل کاهش دهنده ی فلزات (خالص سازی فلزات گران بهای استخراج شده از معدن)
- مهار کننده خوردگی در دیگ بخار صنعتی، نیروگاههای هسته ای و یا حرارتی
- مهار فلزات سنگین ، آهک و آلاینده هایی مانند Br2 ،Cl2 ،NOx در فرایند تصفیه ی آب
- مورد استفاده در سایت های صنعتی با فشار فوق العاده بالا برای مهار نمودن اکسیژن
- عامل پف زا در فوم های پلیمری ( PE, PVC،PMMA ،EVA ولاستیک و…)
نوع بدون آب هیدرازین هیدرات در سوخت های ماهواره مورد استفاده قرار می گیرد و از دهیدراته کردن هیدرازین هیدرات با تقطیر آزئوتروپی و استفاده از آنیلین به عنوان محلول کمکی حاصل می گردد.
یکی از کاربرد های اصلی هیدرازین به عنوان واسطه در تولید مواد شیمیایی کشاورزی مانند هیدرازید مالئیک است.
در برخی آزمایش ها از آمونیاک به جای هیدرازین استفاده می کنند زیرا محتوای انرژی پایین تر در نتیجه پایدارتر است.
هیدرازین در سوخت موشک
هیدرازین در اثر مخلوط شدن با عامل اکسید کننده دیتروژن تتروکسید، N2O4 یک مخلوط هایپرگولیک ایجاد می کند که بسیار انفجاری نیازی به اشتعال ندارد. با سوختن سوخت، سه واکنش انجام می شود که هیدرازین را به گازهای آمونیاک، نیتروژن و هیدروژن تجزیه می کند. در عرض چند میلی ثانیه در محفظه به دلیل گرمازا بودن این واکنش دما از 800 درجه سانتیگراد فراتر می رود. تجزیه آمونیاک گرماگیر است و مقداری از انرژی گرمایی را تلف می کند، اما گازهای نیتروژن و هیدروژن بیشتری تولید می شود که از طریق یک نازل برای ایجاد نیروی رانش از موشک خارج می شود.
اولین سوخت هیدرازین با متانول در طول جنگ جهانی دوم استفاده شد. این هواپیماها تمایل به انفجار داشتند. این امر به همراه نشت سوخت باعث کشته شدن خلبانان بیشتر از آتش دشمن شد.
امروزه در برخی از وسایل نقلیه نظامی از هیدرازین استفاده می کنند، اما بیشتر در اکتشافات فرازمینی استفاده می شود. فضانوردی که از سال 2012 در مریخ ساکن است، از هیدرازین برای فرود بر روی سیاره سرخ استفاده کرد.اینپ ماده در پروژه های فضانوردی ناسا از مرز های زیادی عبور کرده و توانسته با نیروی هیدرازین و تتروکسید دیتروژن وارد مدار مشتری شد.
هیدرازین در دیگ بخار
در بویلرهایی که سطوح کلرید بالا وجود دارد، اثر خوردگی اکسیژن افزایش می یابد. یکی از خواص هیدرازین این است که با اکسیژن واکنش داده و منجر به حذف آن می شود.
همانطور که پیشتر گفتیم هیدرازین با اکسیژن تشکیل آب و نیتروژن داده و این امر در جلوگیری از خوردگی مفید است. هیدرازین در دمای 200 درجه سانتیگراد یا بیشترنیز تجزیه می شود و آمونیاک تشکیل می دهد (3N2H4 → 4NH3 + N2) که به عنوان تنظیم کننده pH عمل می کند.
واکنش های هیدرازین
واکنش هیدرازین با کتون و آلدهید ها
آلدهیدها و کتون ها را می توان با واکنش با هیدرازین به مشتقات هیدرازین تبدیل کرد. این “هیدرازون ها” را می توان با واکنش با باز و گرما به آلکان مربوطه تبدیل کرد. این دو مرحله را می توان در یک واکنش به نام کاهش ولف کیشنر ترکیب کرد که نشان دهنده یک روش کلی برای تبدیل آلدئیدها و کتون ها به آلکان است. معمولاً یک حلال با نقطه جوش بالا، مانند اتیلن گلیکول، برای تأمین دماهای بالا مورد نیاز برای وقوع این واکنش استفاده می شود. توجه داشته باشید گاز نیتروژن به عنوان بخشی از این واکنش تولید می شود.
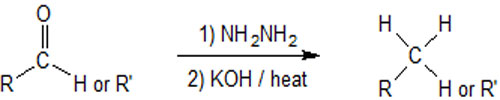
مراحل شامل:
- پروتون زدایی نیتروژن
- پروتوناسیون کربن
خطرات هیدرازین

کار کردن با این ماده نیازمند رعایت نکات ایمنی دارد زیرا این ترکیب بسیار سمی است و می تواند در برخورد با سایر اکسید کننده ها آتش بگیرد. تماس این ترکیب با پوست نیز سمی است و لازم است هنگام استفاده لوازم محافظتی از جمله عینک، دستکش ، ماسک و روپوش حتما مورد استفاده قرار بگیرد. این ماده در صورت حرارت دیدن نیز می تواند منجر به آزاد سازی گاز های سمی اکسید نیتروژن شود.
استنشاق، تماس پوستی و یا بلع این ماده می تواند منجر به صدمات جدی و یا حتی مرگ شود.
حتی این ماده در صورت مشتعل شدن نیز می تواند گازهای سوزش آور ، خورنده و یا سمی تولید کند.
هنگام حرارت دادن این ماده مواظب تولید گاز های سمی، انفجاری و یا منفجر شدن ظرف حاوی این ماده باشید
محدودیت های کاری صورت گرفته برای این ماده:
این ترکیب به دلیل این که سمی می باشد سازمان های زیادی از جمله NIOSH, OSHA, ACFIH قوانینی را برای کارگرانی که با این ترکیب سر و کار دارند وضع نموده اند:
OSHA: مقدار مجاز 1 (ppm (1.3 mg/m3 در طی 8 ساعت کاری
کشور های تولید کننده هیدرازین کدام ها هستند؟
اروپا بزرگترین تولید کننده هیدرازین و به دنبال آن آسیا اقیانوسیه و آمریکای شمالی قرار دارند. در اروپا آلمان بزرگترین تولید کننده این ماده به شمار می رود و پس از آن فرانسه ، بریتانیا و ایتالیا قرار می گیرند. ایالات متحده بیشترین سهم را در آمریکای شمالی به خود اختصاص داده است و چین توانست بزرگترین تولید کننده در آسیا و اقیانوس را به خود اختصاص دهد.
سایر محصولات ضد خوردگی:













نقد و بررسیها
هنوز بررسیای ثبت نشده است.