
در این مقاله به بررسی چگونگی ساخت سدیم هیدروکسید (پرک و مایع) می پردازیم. پس با ما همراه باشید.
بررسی محصول در یک نگاه:
- کاستیک سودا، سدیم هیدروکسید، سود پرک، سود مایع، سود سوزآور همه اسامی ماده ای با فرمول شیمیایی NaOH می باشند.
- این ماده همچنین به عنوان لای lye شناخته شده است ، با این حال ممکن است “لای” به هیدروکسید پتاسیم یا هیدروکسید سدیم اشاره داشته باشد.
- سدیم هیدروکسید هم به صورت مایع با خلوص حدکاثری 50 درصد و هم جامد با خلوص 99 درصد موجود می باشد
- نوع جامد (خالص) این ترکیب عموما برای ساخت شمع و صابون مورد استفاده قرار می گیرد.
- نوع مایع و یا ناخالص در شوینده ها بیشتر مورد استفاده قرار می گیرد
این محصول را از کجا می توان تهیه نمود؟
مغازه های فروش وسایل شمع
فروشگاه های فروش مواد شیمیایی
فروشگاه های صابون سازی
مغازه های فروش سوخت بیودیزل
اگر تمکان خرید این محصول را ندارید ، می توانید از یک واکنش شیمیایی برای ساخت آن استفاده کنید و خودتان آن را در آزمایشگاه سنتز نمایید.
در ادامه به بررسی این روش بیشتر می پردازیم:
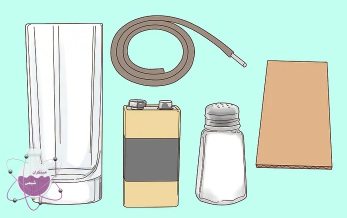
- نمک (سدیم کلرید غیر یونیزه)
- 2 الکترود کربن ( از باتری های روی- کربن و یا باتری های قلمی ساده می توانید این الکترود را تهیه نمایید)
- الکترود های تمساحی
- آب
- منبع تغذیه (باتری 9 ولتی در این آزمایش استفاده شده است)
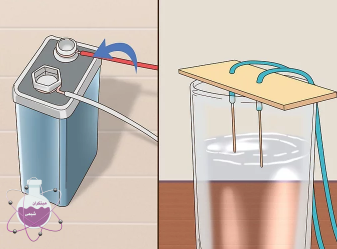
در یک ظرف شیشه ای ، نمک را درون آب هم بزنید تا حل شود. توجه نمایید که از ظروف آلومینیومی استفاده نکنید زیرا هیدروکسید سدیم با این ظروف واکنش نشان داده و به آنها آسیب می رساند.
(2Al (s) + 6NaOH (aq) → 3H2 (g) + 2Na3AlO3 (aq
از واکنش این ماده با آلومینیوم عموما برای تولید هیدروژن استفاده می نمایند.

روش کار:
سیم های تمساحی را به دو الکترود کربنی و باتری وصل کنید و آن را درون محلول ساخته شده با سدیم هیدروکسید قرار دهید. بعد از اعمال پتانسیل باید صبر کنید تا واکنش در طی 7 ساعت کامل شود. این واکنش را حتما در زیر هود انجام دهید زیرا گاز هیدروژن و کلر تولید می شود. در طی این واکنش محلول هیدروکسید سدیم تولید می شود.
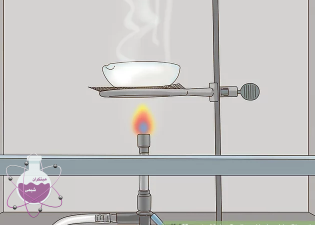
با تبخیر نمودن آب می توان محلول غلیظ از این ماده و یا سدیم هیدروکسید جامد به دست آورید.
واکنش شیمیایی این فرایند الکتروشیمیایی به صورت زیر است:
(2NaCl(aq) + 2 H2O(l) → H2(g) + Cl2(g) + 2 NaOH(aq
توجه نمایید که واکنش تولید این ماده گرمازا است و گرمای قابل توجهی از خود آزاد می کند و حتی محلول ممکن است به اطراف پاشیده شود و یا به جوش بیاید.
نکات ایمنی:
اگر سود مایع بر روی پوستتان ریخت با مقادیر زیادی از آب آن را شست و شو دهید و یا با کمک یک اسید ضعیف (مانند اسید استیک) آن را خنثی نمایید و سپس با آب شست و شو دهید
برای ساخت محلول های مختلف از این ماده حتما NaOH را به آب اضافه کنید و برعکس آن را انجام ندهید.
در هنگام انجام فرایند الکتروشیمی، اطمینان خاطر حاصل نمایید که ظروف مورد استفاده از جنس شیشه بوروسیلیکات (به عنوان مثال پیرکس) می باشند. وجود خراش، شکستگی و یا ترک می تواند در میانه آزمایش سبب شکسته شدن کامل ظرف شود. همچنین اگر از نوع دیگری از شیشه یا شیشه های با مقاومت پایین استفاده می کنید ، احتمالا تغییر دما می تواند باعث خرد شدن آن شود.
به دلیل انتشار گاز های هیدروژن و کلر حتما این فرایند را در زیر هود و در آزمایشگاه های دارای تهویه ی مناسب انجام دهید
استفاده از دستکش ، ماسک، روپوش و عینک ایمنی در حین آزمایش ضروری می باشد. این ماده با قدرت خورندگی بالا (pH ای در حدود 13) می تواند در صورت ریخته شدن بر روی پوست سبب خوردگی و آسیب شدید به آن شود.
شرکت مبتکران شیمی یکی از بزرگترین تامین کنندگان این محصول با بهترین کیفیت می باشد. با ما در ارتباط باشید.
سایر مقاله های مرتبط:
تست تعیین خلوص سود پرک و سود مایع


عالی بود. متشکرم
سپاس از توجه شما
سلام پس از تبخیر نمک هم همراه با سود پرک روی ظرف بافی میمونه چجوری باید از هم جداشون کرد؟
سلام در روش دیافراگمی از دیافراگم برای جداسازی آب و نمک و در روش ممبران از غشا به جای دیافراگم برای حذف نمک استفاده می کنند.
سلام میشه بجای الکترود کربن از نوک مداد استفاده کرد؟
سلام، نوک مداد حاوی ناخالصی مانند خاک رس است و می تواند در نتیجه آزمایش تاثیر منفی بگذارد.