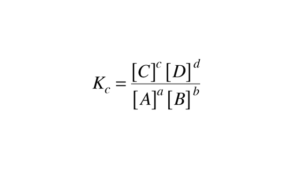عموم مردم فکر می کنند که تمام واکنش های شیمیایی روزی به پایان می رسند، یعنی جایی که تمام واکنش دهنده ها به محصولات تبدیل می شوند. اما آنچه شیمی به ما می گوید با این باور متفاوت است. بسیاری از واکنش ها وجود دارند که تنها تا مقدار معینی پیش می روند، در واقع تمام واکنش دهنده ها به محصولات تبدیل نمی شوند. در این واکنش ها با گذشت زمان غلظت واکنش دهنده ها و فراورده ها ثابت می شود و سیستم به تعادل می رسد. به طور کلی تساوی بین واکنش دهنده ها و محصولات در یک واکنش شیمیایی را تعادل شیمیایی (Chemical equilibrium) می نامند.
در این حالت غلظت واکنش دهنده ها و محصولات ثابت و سرعت واکنش های رو به جلو و رو به عقب با هم برابر است. جالب است بدانید واکنش ها پس از رسیدن به تعادل متوقف نمی شوند و بیشتر قوانین تعادل برای فرایند برگشت پذیر اعمال می شود، از این رو تعادل شیمیایی در یک واکنش برگشت پذیر اتفاق می افتد. تعادل را یک فرایند دینامیکی در نظر می گیرند، اگرچه واکنش ها قابل مشاهده نیستند اما به صورت رفت و برگشتی انجام می شوند.
ویژگی های اصلی تعادل شیمیایی :
برای ایجاد این حالت، سیستم باید بسته (نه ماده ای از آن خارج و نه به آن وارد شود) و واکنش مربوطه از نوع برگشت پذیر باشد. خواص قابل رویت سیستم مانند رنگ، فشار، غلظت و غیره پس از رسیدن به حالت تعادل ثابت و بدون تغییر باقی می ماند. پس از تعادل مقدار واکنش دهنده ها و محصولات ثابت خواهد ماند و تمام واکنش دهنده ها و محصولات در حالت تعادل هستند. همچنین سرعت واکنش های رفت و برگشت با هم برابر است و موقعیت تعادل تحت تأثیر کاتالیزورها قرار نمی گیرد.
انواع تعادل:
در حالت کلی، تعادل را به دو بخش می توان تقسیم کرد.
- تعادل فاز
یک ماده بین دو حالت فیزیکی در تعادل باشد. برای مثال برای ایجاد تعادل در یک فلاسک آب، باید سرعت تبخیر آب با سرعت میعان آن برابر باشد.
- تعادل محلول
یعنی یک ماده ی جامد در یک محلول اشباع در تعادل باشد، برای ایجاد این حالت باید سرعت انحلال با سرعت تبلور مجدد برابر باشد.
در ادامه انواع تعادل شیمیایی را مورد بررسی قرار خواهیم داد.
انواع تعادل شیمیایی:
این حالت را می توان به دو گروه تقسیم کرد:
- تعادل همگن:
در اینجا محصولات و واکنش دهنده ها در یک فاز قرار دارند. تعادل همگن هم می تواند به دو نوع تقسیم شود:
واکنش هایی که تعداد مولکول های محصولات برابر با مولکول های واکنش دهنده است، مانند:
H2(g) + I2(g) ⇔2HI(g)
N2(g) + O2(g) ⇔2NO(g)
واکنش هایی که تعداد مولکول های محصولات با تعداد مولکول های واکنش دهنده ها برابر نیست، مانند:
2SO2(g) + O2(g) ⇔ 2SO3(g)
COCl2(g) ⇔ CO(g) + Cl2(g)
- تعادل ناهمگن:
در این تعادل محصولات و واکنش دهنده ها در فازهای متفاوتی قرار دارند. مانند:
CO2(g) + C(s) ⇔ 2CO(g)
CaCO3(s) ⇔ CaO(s) + CO2(g)
تعادل شیمیایی برحسب فاز واکنش دهنده ها و محصولات تقسیم بندی می شود.
قانون تعادل شیمیایی:
واکنش فرضی برگشت پذیر اولیه زیر را در یک ظرف در بسته در نظر بگیرید.
A و B با هم واکنش داده و محصولات C و D را تولید می کنند، در نظر داشته باشید که این واکنش می تواند در جهت معکوس نیز اتفاق بیافتد. این واکنش تا جایی پیش می رود که غلظت و سرعت واکنش در طرفین با هم برابر شود و سیستم به تعادل برسد. پس از این مرحله دیگر تغییری در غلظت هیچکدام از محصولات ایجاد نمی شود.
ثابت تعادل:
نسبت غلظت تعادلی محصولات تقسیم بر غلظت تعادلی واکنش دهنده ها، که هرکدام به اندازه ی قدرت استوکیومتری آنها افزایش می یابد را ثابت تعادل می گویند.
در واقع هر غلظت به اندازه ی توان ضریب خود در معادله ی شیمیایی افزایش می یابد. این کمیت مستقل از غلظت های اولیه محصولات و واکنش دهنده ها و وابسته به دما است.
تاثیر دما بر ثابت تعادل:
تغییر دما باعث تغییر سرعت های واکنش در نتیجه تغییر ثابت تعادل می شود. اگر ثابت تعادل بزرگتر از یک باشد، غلظت محصولات بیشتر از غلظت واکنش دهنده ها است. ثابت تعادل کمتر از یک، غلظت واکنش دهنده ها بیشتر از محصولات و ثابت تعادل برابر با یک یعنی غلظت محصولات و واکنش دهنده ها با هم برابر است.
عوامل تاثیر گذار بر تعادل:
عواملی مانند دما، فشار، غلظت وجود دارند که بر تعادل تاثیر می گذارند.
غلظت:
هرگاه غلظت واکنش دهنده ها یا محصولات تغییر کند، ترکیب مخلوط تغییر کرده و تعادل شیمیایی ایجاد می شود.
تغییر فشار:
تغییر فشار در سیستم های گازی با سیستم های مایعات و جامدات متفاوت است. در سیستم های گازی تغییر فشار به معنای تغییر حجم است، یعنی تعداد کل واکنش دهنده ها و محصولات تغییر کرده است. اما در تعادل ناهمگن در سیستم های مایعات و جامدات تغییر فشار را بر طبق اصل لوشاتلیه در نظر نمی گیریم.
تغییر دما:
تاثیر دما بر تعادل شیمیایی به علامت آنتالپی وابسته است. برای مثال با افزایش دما، ثابت تعادل در یک واکنش گرمازا کاهش و در یک واکنش گرماگیر افزایش می یابد. همچنین سرعت واکنش نیز به دما وابسته است.
کاتالیزور:
کاتالیزورها فقط سرعت واکنش ها را افزایش می دهند، از این رو بر تعادل شیمیایی تاثیری ندارند و تنها باعث می شوند واکنش ها زودتر به تعادل برسد.
گاز بی اثر:
فرض کنید یک گاز بی اثر مانند آرگون به حجم ثابتی اضافه شود، این گاز در واکنش شرکت نخواهد کرد از این رو تاثیری بر تعادل نخواهد داشت.
چرا به تعادل شیمیایی، تعادل دینامیکی یا پویا می گویند؟
در مرحله تعادل سرعت واکنش های رفت و برگشت و تعداد مولکول هایی تبدیلی به محصول با تعداد مولکول های تبدیلی به واکنش دهنده با هم برابرند. همین واکنش تعادل را می توان با واکنش دهنده های مشابه، در شرایط مشابه با مبادله مداوم مولکول ها انجام داد. در واقع حالت دینامیکی یا پویا یعنی هیچ تغییر خالصی در غلظت واکنش دهنده ها و محصولات رخ ندهد، این همان اتفاقی است که در تعادل شیمیایی رخ می دهد.
تعادل شیمیایی در صنعت:
در بسیاری از فرایندهای صنعتی از تعادل شیمیایی بهره می برند. برای مثال تهیه آمونیاک با فرایند هابر را در نظر بگیرید. نیتروژن با هیدروژن ترکیب می شود و آمونیاک را می سازد. بازده آمونیاک در دمای پایین، فشار بالا و حضور آهن به عنوان کاتالیزور افزایش می یابد.
جمع بندی:
برابری بین واکنش دهنده ها و محصولات در یک واکنش شیمیایی را تعادل شیمیایی می نامند. به دلیل عدم تغییر غلظت در واکنش دهنده ها و فراورده ها این حالت را تعادل دینامیکی یا پویا نیز می نامند. تعادل را می توان به دو گروه همگن و ناهمگن تقسیم بندی کرد. همچنین عواملی چون فشار، دما و غلظت از عوامل موثر بر این حالت به حساب می آیند.