
استفاده از بافر یکی از موراد مهم در شیمی اسید – باز است. در ادامه با مفاهیمی مانند بافر چیست ، نحوه تهیه محلول آن و نحوه محاسبه pH محلول بافر آشنا خواهیم شد.
بافر چیست ؟
دو اصطلاح کلیدی در مورد بافر وجود دارد. بافر محلولی آبی است که دارای pH بسیار پایدار است. عامل بافری اسیدی ضعیف و یا بازی ضعیف است که به ثابت ماندن pH یک محلول آبی پس از افزوده شدن اسید و یا باز به آن کمک می کند. هر محلول بافری دارای یک محدوده عملکردی pH است و می تواند در مقابل مقدار تغییر pH به ازای مقدار مشخصی اضافه شدن باز یا اسید مقاومت کند که به آن ظرفیت بافری گفته می شود.
همانگونه که گفته شد این محلول ها در محدوده خاصی از pH قابل استفاده هستند. در جدول زیر محدوده عملکردی برخی از عامل های بافری آورده شده است:
| بافر | pKa | محدوده pH |
| اسید سیتریک | 3.13، 4.76 ، 6.40 | 2.1 تا 7.4 |
| اسید استیک | 4.8 | 3.8 تا 5.8 |
| KH2PO4 | 7.2 | 6.2 تا 8.2 |
| بورات | 9.24 | 8.25 تا 10.25 |
طرز تهیه بافر
بافر حاصل از مخلوط نمودن مقادیر زیاد اسید ضعیف و یا باز ضعیف با جفت های مزدوج (نمک) آنهاست. یک اسید ضعیف و باز مزدوج آن می توانند در یک محلول بدون خنثی نمودن یکدیگر در کنار یکدیگر بمانند. همین امر در مورد باز ضعیف و اسید مزدوج آن نیز صادق است.
نحوه کار بافرها چگونه است ؟
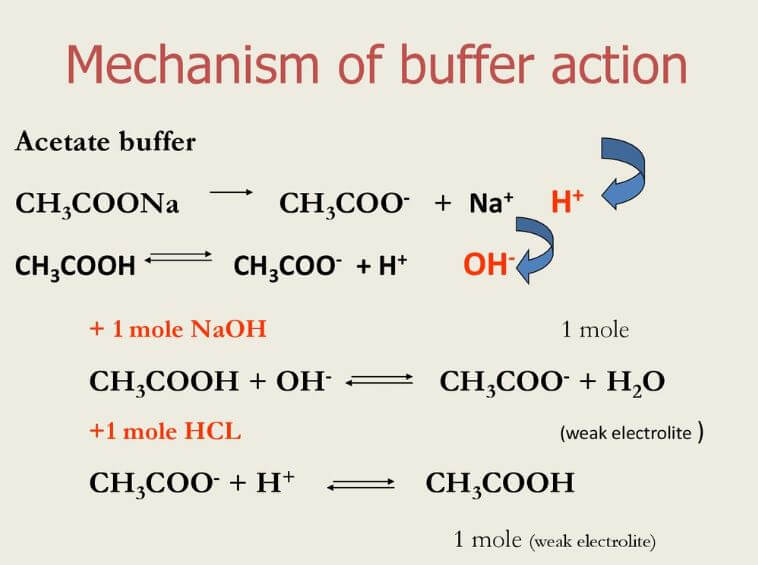
با توجه به اینکه در محلول بافر هم عامل اسیدی و هم عامل بازی وجود دارد، هنگامی که یون های هیدروژن (اسید) به بافر افزوده می شوند توسط باز خنثی می شوند. از سویی یون های هیدروکسید نیز توسط اسید خنثی می شوند. این واکنش های خنثی سازی باعث می شوند تا pH کلی محلول تغییری نداشته باشد.
هنگامی که یک اسید را برای محلول بافر انتخاب می نمایید ، اسیدی با pKa نزدیک به pH مدنظر خود انتخاب نمایید. این کار باعث می شود تا حد ممکن یون های H+ و OH- خنثی شوند.
برای درک بهتر نحوه کار بافرها ، به عنوان مثال محلول بافری که از حل نمودن سدیم استات در اسید استیک تهیه شده است را در نظر بگیرید. اسید استیک به عنوان اسید (CH3COOH) عمل می کند، درحالیکه استات سدیم در محلول جدا می شود تا باز مزدوج یعنی یون های استات را تولید کند. معادله واکنش به صورت زیر است:
CH3COOH(aq) + OH–(aq) ⇆ CH3COO–(aq) + H2O(aq)
اگر یک باز قوی به محلول افزوده شود، یون های استات آن را خنثی می کنند:
CH3COO–(aq) + H+(aq) ⇆ CH3COOH(aq)
این واکنش ها باعث ثابت ماندن pH در محلول خواهند شد. از سوی دیگر باز قوی با اسید استیک واکنش می دهد.
نحوه محاسبه pH محلول بافر
pH یک محلول بافری را با استفاده از معادله هندرسون هاسلباخ محاسبه می کنند که به صورت زیر است :
مثال : pH محلولی با حجم یک لیتر که دارای 1 مول NH3 و 0.4 مول NH4Cl است را محسبه کنید. Kb(NH3) = 1.8 * 10-5 mol L-1
با توجه به معادله هندرسون هاسلباخ ابتدا باید مقدار Ka را از معادله زیر بدست آوریم :
همچنین مقادیر ca= 0.40 mol L-1 و cb=1 mol L-1 را داریم ، در نتیجه :
با جایگذاری مقادیر بدست آمده از معادلات بالا در معادله هندرسون هاسلباخ مقدار pH این محلول بافر برابر است با 9.65 .
بافرهای جهانی
اکثر بافرها در محدوده کوچکی از pH فعالیت می کنند. یکی از اسستثناها اسید سیتریک است زیرا سه مقدار pKa دارد. هنگامی که یک ترکیب مقادیر pKa های مختلفی دارد، محدوده گسترده ای از pH را برای عملکرد محلول بافری به وجود می آورد.
همچنین می توان بافرها را با یکدیگر ترکیب نمود (با تفاوت 2 و یا کمتر در مقدار pKa) و مقدار pH مورد نظر را با افزودن اسید و یا باز قوی تعیین نمود. به عنوان مثال بافر McIvaine ترکیبی از Na2PO4 و اسید سیتریک است. بسته به نسبت مواد ترکیب شده، این محلول می تواند در محدوده pH 3.0 تا 8.0 موثر واقع شود.
مخلوطی از اسید سیتریک، اسید بوریک ، مونو پتاسیم فسفات و دی اتیل باربیتوئیک اسید می تواند در محدوده پی اچ 2.6 تا 12 کار کند.
برای خرید این اسیدها می توانید به لینک های زیر مراجعه کنید:
مثال هایی از بافر
- بی کربنات، در خون به عنوان بافر عمل می کند
- تریس (TRIS)
- فسفات
طرز تهیه بافر فسفات
برای تهیه این محلول مواد زیر مورد نظر هستند:
- مونو سدیم فسفات
- دی سدیم فسفات
- آب
- اسید فسفریک برای اسیدی تر نمودن محلول و یا سدیم هیدروکسید برای بازی نمودن محلول
- پی اچ متر
مراحل انجام کار
1- ابتدا غلظت و pH مورد نظر را تعیین کنید.
2- با استفاده از معادله هندرسون-هسلباخ مقدار اسید و باز مورد نیاز را محاسبه نمایید. برای راحتی کار در این اینجا حجم محلول بافر را 1 لیتر در نظر می گیریم. مقدار pKa را که نزدیک به مقدار pH مورد نظرتان است انتخاب نمایید. به عنوان مثال اگر می خواهید pH محلولتان 7 باشد ، pKa را 6.9 در نظر بگیرید:
pH = pKa + log ([Base]/[Acid])
نسبت [Base]/[Acid] = 1.096 است. مولاریته بافر برابر با جمع مولاریته های اسید و باز مزدوج آن یا جمع [Acid] + [Base] است.
برای تهیه بافر یک مولار داریم:
[Acid] + [Base] = 1 در نتیجه [Base] = 1 – [Acid] است. با جایگذاری این رابطه در معادله هندرسون – هسلباخ غلظت باز به دست می آید.
[Base] = 0.523 moles/L و در نتیجه غلظت اسید نیز [Acid] = 0.477 moles/L می شود.
3- محلول را با مخلوط نمودن 0.447 مول از مونو سدیم فسفات و 0.523 مول دی سدیم فسفات در کمی کمتر از 1 لیتر آب درست کنید.
4- با استفاده از پی اچ متر pH را اندازه گرفته و در صورت لزوم با اسید فسفریک و یا سدیم هیدروکسید ، pH را تنظیم نمایید.
5- زمانی که به پی اچ دلخواه رسیدید با افزودن آب محلول را به حجم 1 لیتر برسانید.
6- محلول تهیه شده با این مقادیر غلظت یک مولار دارد، می توانید آن را با آب رقیق کنید و به غلظت های 0.5 یا 0.1 مولار برسانید.

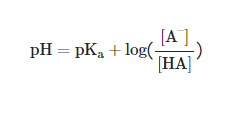
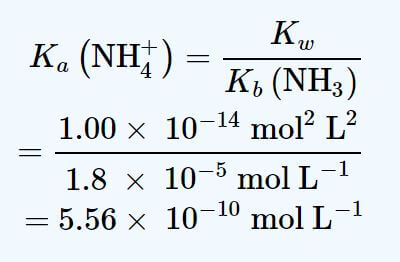
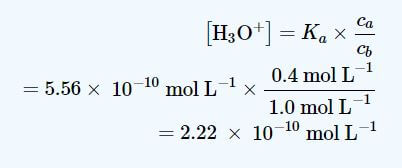

تشکر از شما