اسید چیست؟ تاریخچه و نظریه های مهم پیرامون این مواد کدامند؟ PH این مواد چقدر است؟ روش های شناسایی اسید و باز چیست؟ قوی ترین اسید ها کدامند؟ موارد ذکر شده سوالاتی است که در ادامه مقاله به آنها پاسخ خواهیم داد پس با ما همراه باشید.
بررسی تاریخچه:
همانطور که گفته شد تعریف های متنوعی برای این مواد در طول تاریخ ارائه شده است آرنیوس اولین نفری بود که نظریه ی اولیه را درباره ی این مواد بیان نمود.
-
نظریه ی آرنیوس:
در تعریف آرنیوس اسید و باز به صورت زیر تعریف می شوند:
اسید : H+ آزاد می کند
باز: OH- تولید می کند.
این تعریف توسط سوانته آرنیوس در سال 1883 ارائه گردید. بعد ها نظریه های دیگری پیرامون اسید و باز ارائه گردید:
آرنیوس به این نتیجه رسید که هنگامی که اسید یا باز در محلول ریخته شود یون های خاصی را در محلول آزاد می نمایند. یون های H+ که هنگام حل شدن اسید در محلول آبی حاصل می شوند در ترکیب با آب تشکیل یون هیدرونیوم را می دهند H3O+
(HCl (aq)→H+(aq)+Cl−(aq
به عنوان مثال در واکنش زیر HClزمانی که به محلول آبی انتقال داده می شود. به دو یون کلر و هیدروژن تقسیم می شود. در این واکنش یون هیدروژن در واکنش با آب تبدیل به یون هیدرونیوم می شود:
(HCl(aq)+H2O(l)→H3O+(aq)+Cl−(aq
خرید انواع اسید با بهترین قیمت از مبتکران شیمی

|

|
-
نظریه ی برونستد:
تئوری آرنیوس توانست به خوبی واکنش اسید و باز ها را با یکدیگر برای تشکیل نمک و آب توجیح نماید. اما هرگز نتوانست توصیح دهد که چرا مواد فاقد یون هیدروکسید مانند F- و NO2- نیز می توانند در آب محلول های بازی تولید نمایند.
در سال 1923 شیمیدان هایی با نام های یوهانس نیکولوس برونستد و توماس مارتین لوری تعاریف جداگانه ای از اسید و باز را بر اساس توانایی های این ترکیبات برای اهدا یا پذیرش پروتون ها (یون های H +) ارائه دادند.
در این تعریف ، اسیدها به عنوان اهدا کننده و باز ها پذیرنده ی پروتون معرفی می شوند. ترکیبی که هم به عنوان اسید و هم باز شناخته شود آمفوتریک نامیده می شود.
هنگامی که یک اسید برونستد تجزیه می شود ، غلظت یون های هیدروژنH+در محلول افزایش می یابد. برعکس ، باز برونستد با گرفتن پروتون از حلال (آب) برای تولید [OH−] جدا می شوند.
فرمول:
باید توجه نمود که در واکنش های تعادلی هر اسید (HA) یک باز مزدوج (A−) دارد و بالعکس.
برای یک اسید یا باز مشخص ، این تعادل ها با تعادل تفکیک آب در ارتباط هستند:
H2O(l)⇌H+(aq)+OH−(aq
[-Kw=[H+][OH
در این تعادل Kw= 1.00 * 10-14 در دمای 25 درجه ی سانتی گراد می باشد
طبق مطالعات صورت گرفته Ka و Kb معادل با Kw می باشند.
- نظریه ی لوئیس:
نظریه لوئیس بیان می کند که اسیدها به عنوان گیرنده جفت الکترون عمل می کنند و باز ها به عنوان اهدا کننده جفت الکترون عمل می نمایند. در این نظریه برخلاف دو نظریه ی پیشین هیچ حرفی از هیدروژن به میان نیامد و تنها بحث بر روی انتقال الکترون صورت پذیرفت. لوئیس توانست کامل ترین نظریه را پیرامون این موضوع ارائه دهد.
برای توضیحات بیشتر به مثال زیر توجه نمایید:
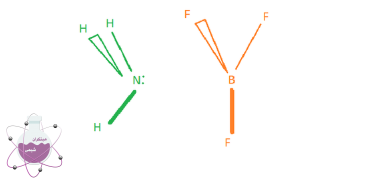
NH3+BF3->H3NBF3
واکنش فوق میان تری فلوئورو بور و آمونیاک صورت پذیرفته است. از آنجا که انتقال اتم های هیدروژن در اینجا وجود ندارد ، واضح است که این واکنش از نوع اسید-باز لوئیس است. در این واکنش NH3 دارای یک جفت الکترون تنها است و BF3 به دلیل آن که بور الکترون کافی در اطراف خود برای هشتایی شدن ندارد آماده ی پذیرایی الکترون می باشد
طبق ساختار فوق از آنجایی که بور تنها 6 الکترون در اطراف خود دارد جفت الکترون ازت را می تواند دریافت نماید. در این حالت شاهد برقراری پیوند بین نیتروژن و بور خواهیم بود.
در نتیجه BF3 اسید و NH3 باز می باشد.
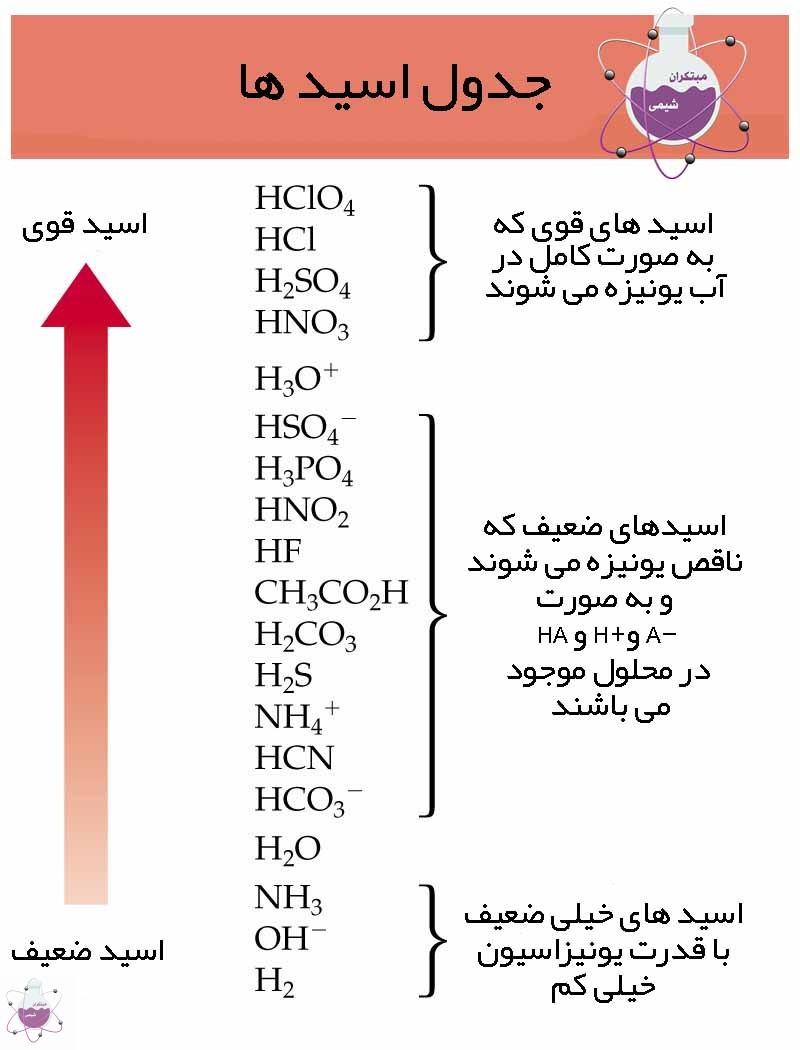
اسید و باز قوی :
اسید قوی موادی هستند که در آب به راحتی یونیزه می شوند و به یون های هیدروژن برای اسید و آنیون تفکیک می شوند. تعداد کمی از این مواد قوی هستند و اغلب به طور کامل درآب تفکیک نمی شوند و جز دسته بندی ضعیف قرار می گیرند.
اسیدهای قوی: HCl ، HNO3 ، H2SO4 ، HBr ، HI ، HClO4
اسیدهای ضعیف: تمام اسیدهای دیگر مانند HCN ، HF ، H2S ، HCOOH
باز قوی: هیدروکسید های فلزات گروه I و گروه II مانند LiOH ، NaOH ، KOH ، RbOH ، CsOH
باز های ضعیف: مانند NH3 ، CH3NH2 ، C5H5N
روش تشخیص اسید و باز چگونه است ؟
1-واکنش پذیری
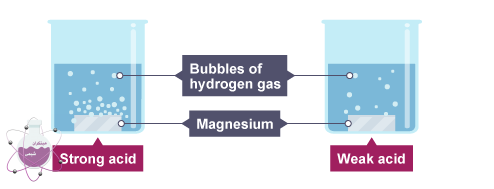
از آنجایی که نوع قوی به طور کامل در آب یونیزه می شود و می تواند حداکثر میزان هیدروژن را تولید نماید پس pH کمتری خواهد داشت. در نتیجه میزان واکنش اسیدهای قوی با موادی مانند فلزات ، کربنات های فلزی و غیره بسیار بیشتر از نوع ضعیف است.
همانطور که در شکل بالا نیز مشخص است، در واکنش با منیزیم مقدار حباب های هیدروژن تولید شده توسط نوع قوی بسیار بیشتر از نوع ضعیف است.
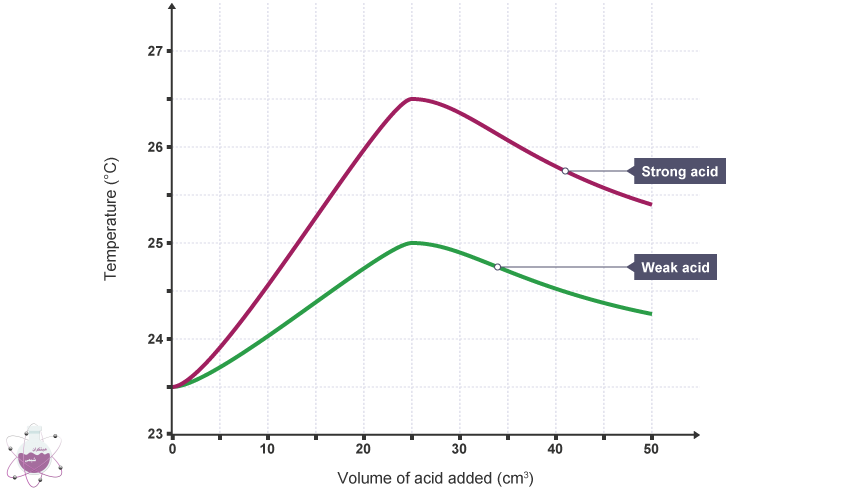
همین امر دلیل تولید گرما در واکنش با اسید های قوی نسبت به ضعیف را نیز توجیح می کند. در شکل نمودار دمایی مربوط به واکنش با این مواد آورده شده است:
2-استفاده از شناساگر : با انحلال پذیری این مواد در آب می توان محلول هایی با مقدار pH متفاوتی به دست آورد و این به میزان تفکیک یون هیدروژن بستگی دارد.
این ترکیبات را می توان با شناساگر مناسب شناسایی کرد. این شناساگر ها با تغییر رنگ می توانند به ما در تشخیص اسید و باز (قوی یا ضعیف ) کمک نمایند:
3-ثابت تعادل
با نوشتن یک ثابت تعادل برای واکنش می توانید موقعیت تعادل را بدست آورید. هرچه مقدار ثابت پایین تر باشد ، تعادل در سمت چپ بیشتر است و اسید ضعیف تر خواهد بود.
HA+H2O⇆H3O+ + A–
[Kc=[H3O+][A-]/[HA][H2O
همچنین ویژگی هایی مانند مزه، بو و… را می توان معیار تشخیص این دو از یکدیگر دانست که در جدول زیر قابل مشاهده است :
| خصوصیت | اسید | باز |
| pH | کمتر از 7 | بیشتر از 7 |
| کاغذ لیتموس | آبی به قرمز | می تواند کاغذ اسیدی لیتموس (قرمز) را به رنگ آبی تغییر رنگ دهد |
| طعم | ترش (مانند سرکه) | تلخ و صابونی ( مانند جوش شیرین) |
| بو | بوی تند و زننده | اغلب بدون بو (استثنا آمونیاک است) |
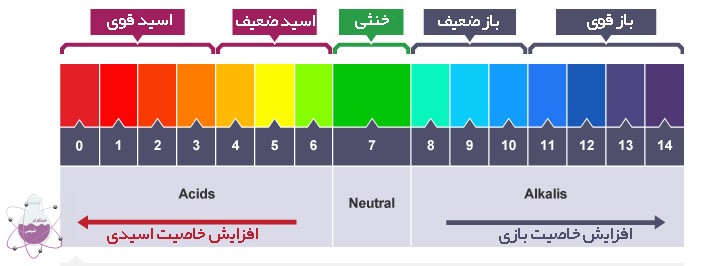
pH اسید و باز
از آنجا که اسید ها در محلول میزان یون های H را افزایش می دهند و باز ها میزان یون های هیدروکسیل را افزایش می دهند ، با کمک pH ، قدرت اسیدیته و بازی را با سنجش غلظت یون های H می توان اندازه گیری کرد. فرمول آن را در زیر می توانید مشاهده نمایید:
[+pH = -log[H
pH معمولا در دامنه ی 1 تا 14 قرار دارد (اما نه همیشه). چیزی با pH کمتر از 7 نشان دهنده خاصیت اسیدی است و بیشتر از 7 نشان دهنده خصوصیات بازی است. هرچه [H +] بیشتر باشد ، pH پایین تر خواهد بود.
-
آیا pH می تواند منفی باشد؟
بله اگر از غلظت های بالای 1 مولار اسید استفاده کنید pH آن منفی خواهد بود. مثلا هیدروکلریک اسید 2 مولار pH ای در حدود -0.3 خواهد داشت. فرمول آن مطابق زیر است:
(+pH=-log (H
log2=-0.3-
آشنایی با چند اسید پرکاربرد :
در ادامه با چند اسید متداول و ساختار آن ها بیشتر آشنا خواهیم شد:
-
استیک:
فرمول شیمیایی: HC2H3O2
عناوین دیگر: اتانوئیک اسید، CH3COOH ، AcOH
این ماده در سرکه یافت می شود. سرکه حاوی 5 تا 20 درصد از این ماده می باشد.
شکل ظاهری این ماده اغلب مایع است اما این ماده به صورت خالص (گلاسیال) در دماهای پایین تر از دمای اتاق کریستالیزه می شود
-
بوریک
فرمول شیمیایی: H3BO3
عناوین دیگر: هیدروژن ارتوبورات، acidum boricum
این ماده به منظور ضد عفونی سازی و سموم دفع آفات استفاده می شود و اغلب به صورت پودری و سفید رنگ است. بوراکس یک نمونه از ترکیبات این ماده است.
-
کربونیک
فرمول شیمیایی: CH2O3
عناوین دیگر: دی هیدروژن کربنات، اسید هوا و.. .
محلول های دی اکسید کربن در آب (آب گازدار) می توانند اسید کربنیک نامیده شوند. این ترکیب اسیدی ضعیف است این ماده می تواند سبب انحلال سنگ آهک برای تولید ویژگی های زمین شناسی مانند استالاگمیت ها و استالاکتیت ها شود.
-
هیدروکلریک
فرمول شیمیایی: HCl
عناوین دیگر: اسید کلریدریک، هیدروژن کلرید
این ماده که بسیار خورنده می باشد در نوع رقیق با نام موریاتیک اسید شناخته شده و کاربردهای صنعتی و آزمایشگاهی زیادی دارد.برای اهداف صنعتی، این محصول معمولا شامل 20 تا 35 درصد اسید هیدروکلریک است ، در حالی که این درصد در اسید موریاتیک با استفاده خانگی بین 10 تا 12 درصد می باشد.
-
فسفریک:
فرمول شیمیایی: H3PO4
اسید فسفریک اسیدی معدنی است و در مصارف خانگی به عنوان تمیز کننده مورد استفاده قرار می گیرد. گرید صنعتی این ماده یک مهار کننده ی ضد زنگ است و در ساخت انواع کود ها به وفور مورد استفاده قرار می گیرد
-
اگزالیک
فرمول شیمیایی: H2C2O4
نام های دیگر: اسید اتاندیوئیک، هیدروژن اگزالات
اسید اگزالیک به صورت طبیعی در برگ های سبز و گیاهان نیز یافت می گردد و خاصیت ضد زنگ و از بین بردن کنه واروا را در زنبورداری دارد.
-
فرمیک
فرمول شیمیایی : CH2O2
این ماده با نام جوهر مورچه هم شناخته می شود. زیرا مورچه ها نیز این ماده را از خود منتشر می نمایند. اسید فرمیک در نساجی و تهیه ی خوراک دام کاربرد عمده ای دارد.
واکنش خنثی شدن در اسید ها چگونه اتفاق می افتد؟
هنگامی که یون H+ با یون oH- مواجه می شود این یون ها می توانند منجر به تولید آب گردند.
(H+(aq) + OH–(aq) → H2O(l
از آنجا که واکنش های خنثی سازی باعث از بین رفتن و به دست آوردن یون های هیدروژن می شود ، این فرآیند را “انتقال پروتون” می نامند.
خنثی سازی در اسید ها با کمک باز ها صورت می گیرد و یون های OH- موجود در باز ها با H+ موجود در اسید وارد واکنش می شود و تولید آب می کند. محصول دیگر حاصل این واکنش نمک است.
منابع:
ibretexts. (2019, September 30). Overview of Acids and Bases. Retrieved April 18, 2020, from https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules
خرید و فروش مواد شیمیایی را به ما در مبتکران شیمی بسپارید