کربنات سدیم (Sodium carbonate) که با نام تجاری سودا اش (Soda ash) نیز شناخته می شود. دارای دو فرم سنگین و سبک است که در ادامه به مشخصات هر کدام و تفاوت های آن ها خواهیم پرداخت. در حل جدول از کربنات سدیم با نام های سودا اش ، قلیاب یا قلیا نیز یاد می شود.
.مشخصات فیزیکی و شیمیایی :
| فرمول شیمیایی | Na2CO3.nH2O که n می تواند 0 ، 1 و یا 10 باشد . |
| جرم مولی | 105.988 گرم بر مول |
| مشخصات ظاهری | کریستال های بی رنگ و یا سفید ، پودر سفید و یا بی رنگ |
| نقطه جوش | در اثر حرارت تجزیه شده و گاز کربن دی اکسید آزاد می کند |
| دمای ذوب | 851 درجه سانتی گراد |
| نام تجاری | سودا اش |
کربنات سدیم چیست؟
کربنات سدیم (Sodium carbonate) با نام تجاری سودا اش (Soda ash) ترکیبی غیرآلی با فرمول شیمیایی Na2CO3 است. کربنات سدیم به شکل کریستال یا پودر سفید یا بی رنگ با نقطه ذوب 851ºC و جرم مولکولی 105.988 گرم است. به دو دسته ی سبک و سنگین تقسیم بندی می شود. این ترکیب معدنی در صنایع غذایی، تصفیه آب و تولید مواد شیمیایی مانند شوینده ها کاربرد دارد.
تفاوت سدیم کربنات سبک و سنگین چیست ؟
کربنات سدیم به دو دسته سبک و سنگین تقسیم بندی می شود که هر دو شکل آن کاربردهای متفاوتی دارند. این دو ترکیب به لحاظ شیمیایی تفاوتی در ساختار مولکولی خود ندارند و از این لحاظ کاملا یکسان هستند. تنها تفاوت آن ها در چگالی و اندازه کریستال های آن ها و در واقع خواص فیزیکی شان است. نوع سبک این محصول یک پودر ریز سفید رنگ است که بوی خاصی ندارد و چگالی آن نصف فرم سنگین آن است و در حدود 77/0 گرم بر لیتر است. کربنات سدیم سبک حاوی کمتر از 0.5 درصد سدیم کلرید نیز هست. بیشترین کاربردهای کربنات سدیم سنگین به عنوان ماده جامد است، به خصوص در ساخت شیشه و کاشی و سرامیک. استفاده از سدیم کربنات سبک به طور سنتی به عنوان ماده شیمیایی در محلول مورد نیاز است. به طور کلی، حدود 50٪ از کل تولید سدیم کربنات در ساخت شیشه و مربوط به نوع سنگین آن بوده، 18٪ در ساخت سایر مواد شیمیایی و 10٪ در صابون ها و مواد شوینده و باقی آن در صنایع غذایی و دارویی استفاده می شود.

فرایند تولید کربنات سدیم سبک
سودا اش از طریق روش های زیر تولید می شود:
- روش لبلان (روش قدیمی)
- تولید از نمک معمولی
- از محلول سیاه قلیایی حاصل از پسماند خمیر کاغذ
از زمانی که روش اول تولید از سولفات سدیم کاملا منسوخ شد، روش دوم فقط در تولید انبوه مورد استفاده قرار می گیرد. در روش تولید دوم ، NaCl با محلول آمونیاک ، دی اکسید کربن و آب وارد عمل می شود. امروزه در ایران تولیدکنندگانی مانند کاوه ، مراغه ، فیرزوآباد ، سمنان و … فعال هستند.
تولید به روش سولوی
این روش به دلیل ارزان بودن و استفاده از مواد خامی که به فراوانی در دسترس هستند برای تولید سدیم بی کربنات و Sodium carbonate به صورت گسترده مورد استفاده قرار می گیرد . مواد خام مورد نیاز برای انجام این فرآیند عبارتند از:
- آمونیاک
- کربن دی اکسید
- آب
- محلول غلیظ آب نمک
تهیه کربنات سدیم از جوش شیرین
جوش شیرین یا همان سدیم بی کربنات را با حرارت دادن در یک اجاق به مدت یک ساعت می توان به این ترکیب تبدیل نمود. حرارت دادن باعث می شود تا کربن دی اکسید و آب از آن خارج شوند. واکنش شیمیایی این فرآیند به صورت زیر است :
2NaHCO3 (S) → Na2CO3 (S) + CO2 (g) + H2O (g)
تولید از پساب خمیر کاغذ
روش سوم که استفاده از خمیر کاغذ می باشد فقط در تولید محدود و مقیاس کم کاربرد دارد ، در این روش سودا اش از پسماند خمیر کاغذ و صنایع کاغذ سازی، تهیه می گردد و در مقایسه با روش های دیگر ارزان تر می باشد.
در اثر گداختن قلیای مصرف شده ی حاصل از عملیات خمیر کاغذ، ماده ی جامدی به دست می آید که ترکیبات اصلی آن شامل کربنات های سدیم، سدیم سولفید(Na2S) و سولفات سدیم می باشد که حدود 60 درصد آن تنها شامل کربنات سدیم است. این ماده را به یک مخزن حل کننده می ریزند و آنرا معمولا در درجه حرارت 780-870 درجه ی سانتی گراد به صورت محلول آبکی در می آورند. محلول فوق را در سطوح فلزی خنک می کننده تا به شکل ذرات جامد ریز و گداخته شده تبدیل گردد.سپس این ذرات را با کمک آسیاب، خرد می کنند.
عمل سرد کردن و تبدیل آن به حالت جامد به وسیله ی آسیاب کردن محلول آبکی Soda ash و Na2S به دست می آید که آن را به مخزن نگهداری منتقل می کنند تا بعدا به برج استخراج کننده ی جامد-مایع پمپ شود.
Na2S در حین شست و شو جدا شده و سودا اش نیز در پایین برج جمع می شود. نمودار جریان تولید سودا اش از پساب خمیر کاغذ به شرح زیر می باشد:
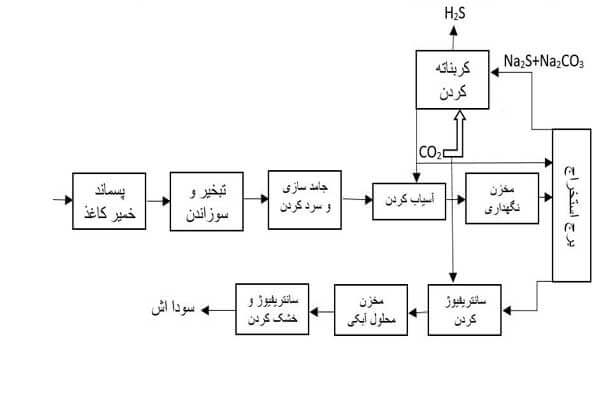
-
خالص سازی و بازیافت
این ماده به صورت مایع را به طور پیوسته به داخل یک جدا کننده نظیر سانتریفیوژ می ریزند تا مواد جامد از آن جدا گردد. محلول بالای برج که غنی از Na2S می باشد را به مخزن کربناته کردن ، جهت ایجاد واکنش با دی اکسید کربن و تولید سولفید هیدروژن و سدیم کربنات پمپ می کنند.
محلول آبکی حاوی سدیم کربنات را خارج می کنند و با محصول موجود در پایین برج مخلوط می کنند. سپس آنرا سانتریفیوژ و خشک می کنند تا Sodium carbonate بازیافت گردد.
استخراج این ماده شیمیایی از منابع معدنی مانند ترونا( تری سدیم هیدروژن دی کربنات دی هیدرات) و نفلین (نوعی کانی) است. که بزرگترین منابع و ذخایر ترونا در برخی کشورها مانند آمریکای شمالی وجود دارد. کربنات سدیم ترکیه نیز از منبع ترونا تامین می گردد.
تولید کربنات سدیم سنگین
این ماده شیمیایی بعد ازاختلاط کربنات سدیم سبک با آب و قرار گرفتن در فرآیند هیدراسیون تشکیل مونو هیدرات می دهد. در پروسه خشک شدن و از دست دادن آب (دهیدراته)، کریستال های کربنات سدیم به جای می ماند.
کاربرد های کربنات سدیم
نوع سبک تر آن طبیعتا چگالی کمتری دارد و نوع سنگین تر آن، چگال تر است. از نوع سبک این ماده در صنعت نفت و گاز و تصفیه آب کاربردی است و نوع سنگین آن در صنعت تولید مواد شیمیایی استفاده می شود.
به طور کلی این محصول جدا از سنگین و سبک بودن در تولیدات گوناگونی از جمله:
- سیلیکات سدیم
- شیشه و سرامیک
- رنگدانه ی آبی لاجوردی
- پاک کننده های پودری
- بی کرومات ها
مورد استفاده قرار می گیرد.
-
کاربرد سدیم کربنات سنگین
مهم ترین و اصلی ترین کاربرد این ماده در تولید شیشه است. برای ذوب سیلیس خالص به دمای حداکثر 2000 درجه ی سانتیگراد نیاز می باشد ، بنابراین اکثر تولید کنندگان با مخلوط کردن ماسه خام با 18٪ سودا اش (Na2CO3) در هزینه های سوخت صرفه جویی می کنند.کربنات افزوده شده نقطه ی ذوب را پایین می آورد و به شکل گیری بهتر شیشه کمک می کند، اما سدیم اضافه شده باعث می شود سیلیس به آرامی در آب حل شود. افزودن حدود 10٪ سنگ آهک (CaCO3) به دلیل وجود کلسیم موجب می شود تا شیشه مقاوم تر گردد.
کاربرد سدیم کربنات سبک
-
کاربرد سدیم کربنات خوراکی در صنایع غذایی:
در صنایع غذایی از این محصول (E500) بعنوان تنظیم کننده میزان ترشی و پایدار کننده استفاده میشود. همچنین عامل جایگزین برای قلیایی کردن به خصوص در چوب شور به جای NaOH به کار می رود. از کاربردهای دیگر آن برای تهیه سریع تر ماکارونی نیز می توان اشاره نمود. سودا اش در تولید بستنی چوبی نیز بکار میرود. احساس خنکی که هنگام خوردن بستنی به ما دست میدهد ( زمانی که بستنی با بزاق دهان خیس میشود) به دلیل واکنش گرماگیر بین این ماده و اسید ضعیف است که منجر به تولید کربن دی اکسید می شود.
-
تصفیه آب
از این ماده بعنوان یک افزودنی رایج در مخازن شهری جهت خنثی سازی اثر اسیدی و کلر استفاده میشود
در ازمایشگاه های شیمی به دلیل پایدار بودن و سهولت در اندازگیری دقیق به عنوان عامل اصلی تیتراسیون اسید و باز شناخته میشود. از مصارف خانگی آن می توان به عنوان نرم کننده آب در شست و شوی لباس ها اشاره کرد.

-
کاربرد در آب استخر
یکی از مشکلاتی که در آب بسیاری از استخرها به وجود می آید تنظیم نبودن pH است. تنظیم نبودن اسیدیته علاوه بر مشکلاتی که می تواند برای پوست و سایر اجزای در تماس با آب به وجود آورد، می تواند عملکرد موادی را که به منظور ضدعفونی، تنظیم سختی و … به اب افزوده می شوند را نیز تخت تاثیر قرار دهد.
-
ساخت سایر مواد شیمیایی:
از کربنات سدیم برای تولید بیکربنات سدیم استفاده می شود. همچنین در تهیه بوراکس و بی سولفیت سدیم نیز از این ترکیب استفاده می شود.
-
تهیه مواد شوینده:
این ماده به علت خواص آنتی باکتریال و پاک کنندگی و همچنین خاصیت امولسیون کنندگی که دارد به حل شدن شوینده و جلوگیری از رسوب کمک می کند. در تهیه صابون های و مایعات ظرفشویی و پودرهای لباسشویی برای ایجاد کف بیشتر و از بین بردن لکه ها استفاده می شود. همچنین در شامپوها به عنوان تنظیم کننده pH و در تولید خمیر دندان کیفیت پاک کنندگی و رفع جرم دندان را بالا می برد. این ماده شیمیایی برای تنظیم PH شامپو نیز به کار می رود.
- از بین بردن سختی آب:
از آنجایی که آب سخت دارای یون هایی محلول همچون کلسیم و منیزیوم است، از سدیم کربنات سبک برای نرم کردن آب استفاده می شود. چرا که سدیم کربنات و کربنات منیزیوم در آب نامحلول هستند.
- ساخت سایر مواد شیمیایی:
از کربنات سدیم در تولید بی کربنات سدیم به کار می رود. می توان از این ماده در آتش خاموش کننده ها استفاده کرد. همچنین در تهیه بوراکس و بی سولفیت سدیم نیز از این ترکیب استفاده می شود. در فرآیند تولید پنبه نیز جهت خنثی کردن سولفوریک اسید بسیار کاربرد دارد.
سایر کاربردها :
- تنظیم کننده اسیدیته
- الکترولیز
- تولید کاغذ
- تیتراسیون اسید و باز
- از بین بردن لکه های موجود در روغن و الکل
- ضد رسوب
- آجرپزی
یکی از بهترین راه ها برای تنظیم اسیدیته استفاده از ترکیباتی شیمیایی است که بتوانند باز یا اسید موجود در آب را خنثی نمایند. در صورت اسیدی بودن آب استخر از کربنات سدیم استفاده می شود. این ماده در تماس با اسیدها آن را خنثی نموده و گاز کربن دی اکسید تولید می نماید. در ادامه به نحوه عملکرد و مکانیسم واکنش این ترکیب با اسید کلریدریک و اسید سولفوریک بیشتر خواهیم پرداخت:
واکنش های رایج کربنات سدیم :
1. واکنش سدیم کربنات با اسید کلریدریک
هنگامی که این دو ماده با یکدیگر واکنش می دهند مقادیر بسیار زیادی، گاز کربن دی اکسید، آب و نمک خوراکی تولید می شود. در اثر ترکیب شدن این دو ماده با یکدیگر، دو مولکول HCl اتم های هیدروژن خود را به کربنات سدیم می دهند. این عمل باعث تولید کربونیک اسید با فرمول شیمیایی H2CO3 می شود. سدیم موجود در سدیم کربنات نیز با یون های کلرید موجود در اسید هیدروکلریدریک ترکیب شده و تولید سدیم کلراید یا همان نمک خوراکی می کند. کربونیک اسید نیز که ماده ای ناپایدار است ، به کربن دی اکسید و آب تجزیه می شود.
این واکنش با توجه به اینکه توانایی حذف اسید کلریدریک را دارد، در مصارف صنعتی جایی که قصد حذف اسید اضافی و یا به تعادل رساندن با کم کردن مقدار اسید را دارند مورد استفاده قرار می گیرد. انجام این واکنش در خانه و بدون داشتن تجهیزات مناسب توصیه نمی شود.
2. واکنش با اسید سولفوریک
این واکنش نیز به ترتیب زیر اتفاق می افتد منجر به تولید سولفات سدیم، کربن دی اکسید و آب می شود. در این واکنش نیز کربن دی اکسید به صورت گازی از محیط واکنش خارج می شود.
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
مضرات کربنات سدیم
در صورت حمل نامناسب و یا نشت تصادفی، می تواند خطراتی را برای سلامتی و ایمنی به وجود آورد. استنشاق کربنات سدیم می تواند اثراتی نامطلوب مانند تحریک سیستم تنفسی، سرفه، تنگی نفس و ورم ریوی به وجود آورد.
تماس چشمی می تواند باعث آسیب دائمی به قرنیه و سوختگی شود. اگر در خانه و یا سایر محیط ها از این ماده استفاده می کنید مطمئن شوید در معرض گرد و غبار آن قرار نگیرید. خطرات ذکر شده ایجاب می کنند که سدیم کربنات باید با احتیاط مورد استفاده قرار گیرد.
- ایمنی حمل و کمک های اولیه
برای حفظ سلامتی خود در هنگام تماس و کار با سدیم کربنات از عینک، دستکش، پوشش آزمایشگاهی و ماسک استفاده کنید. در صورت قرار گرفتن در معرض آن حتما از مراقبت های پزشکی استفاده کرده و موارد زیر را به عنوان کمک های اولیه انجام دهید:
تفاوت سدیم کربنات و جوش شیرین
از لحاظ شیمیایی این دو ترکیب بسیار به یکدیگر نزدیک هستند. فرمول شیمیایی سدیم کربنات Na2CO3 است و فرمول شیمیایی سدیم بی کربنات NaH2CO3 است. هر دو ترکیباتی یونی هستند و هنگامی که در آب حل می شوند یون مثبت Na و یون منفی کربنات آزاد می کنند. علاوه بر این سدیم بی کربنات یون مثبت هیدروژن نیز آزاد می کند.
هر دو ماده به صورت پودر سفید جامد هستند و در تماس با پوست حساسیتی ایجاد نمی کنند، اما در تماس با چشم و یا بلع می توانند مشکلاتی را به وجود آورند. سدیم کربنات عموما در تولید شیشه و سایر مواد شیمیایی به کار برده می شود، اما سدیم بی کربنات بیشتر در آشپزی ، تمیزکاری و … کاربرد دارد.






