توضیحات
این اسید با نام اسید سولفوریک؛ در شرایط اتاق مایعی با ویسکوزیته بالا و بی رنگ است. جوهر گوگرد نیز از جمله نام هایی هست که به این ماده اطلاق می شود اما امروزه زیاد مورد استفاده عموم نیست. این ماده در صنایع غذایی و خوراکی، صنعتی، کشاورزی، شوینده ها و… مورد استفاده قرار می گیرد. در ادامه ی متن با خواص، ویژگی ها،کاربرد، خطرات، قیمت و نحوه خرید این اسید آشنا خواهیم شد. برای فروش و یا خرید اسید سولفوریک و اطلاع از قیمت ها و ثبت سفارش با مشاوران ما در ارتباط باشید.
خرید و فروش اسید سولفوریک:
مبتکران شیمی می تواند مواد مورد نیاز صنایع گوناگون را در کمترین زمان ممکن و با بهترین کیفیت به صنعتگران عزیز در سراسر ایران برساند. برای ثبت سفارش خود از طریق راه های موجود با ما در ارتباط باشید.
اسید سولفوریک چیست ؟
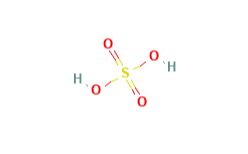
Sulfuric acid با فرمول شیمیایی H2SO4 مایعی روغنی و بیرنگ است که به صورت گرمازا در آب حل می شود و باعث خوردگی فلزات و کاغذ می گردد. در صورت تماس با اغلب مواد معدنی باعث خوردگی می گردد اما بعید است که باعث آتش سوزی شود.
قرار گرفتن در معرض غلظت کم آن به مدت طولانی و یا قرار گرفتن در معرض غلظت بالای آن به مدت کم، می تواند از طریق استنشاق اثرات نامطلوبی بر سلامتی انسان بگذارد. در تولید کود و سایر محصولات شیمیایی، در پالایش نفت، در تولید فولاد و آهن و بسیاری دیگر از فرآیندهای شیمیایی از ماده ی فوقاستفاده می شود.
کسانی که این ماده را خورده اند، قبل از پدیدار شدن علائم خوردگی، مزه شیرین در زبان خود حس کرده اند.
خواص فیزیکی و شیمیایی
برخی از خواص فیزیکی و شیمیایی این محصول در جدول زیر نشان داده شده است :
| فرمول شیمیایی | H2SO4 |
| جرم مولکولی | 98.08 g/mol |
| شکل ظاهری | شفاف، مایع و بی رنگ |
| دانسیته | 1.84 g/cm³ |
ساختار مولکولی این محصول را در شکل زیر می توانید مشاهده کنید.لازم به ذکر است این ترکیب بر خلاف موادی مانند اگزالیک اسید, اسید فرمیک , اسید فسفریک و اسید استیک یک ترکیب اسیدی قوی محسوب می شود.
حلالیت
این ترکیب شیمیایی با آب و الکل قابل امتزاج است و در هنگام تماس گرمای زیادی تولید میشود، علاوه بر این باعث کاهش حجم محلول نیز می گردد. سرب و فولاد میانی در برابر غلظت بالای این ماده دچار خوردگی نمی شوند، اما اکثر فلزات در فرم رقیق شده این ماده دچار خوردگی می گردند.
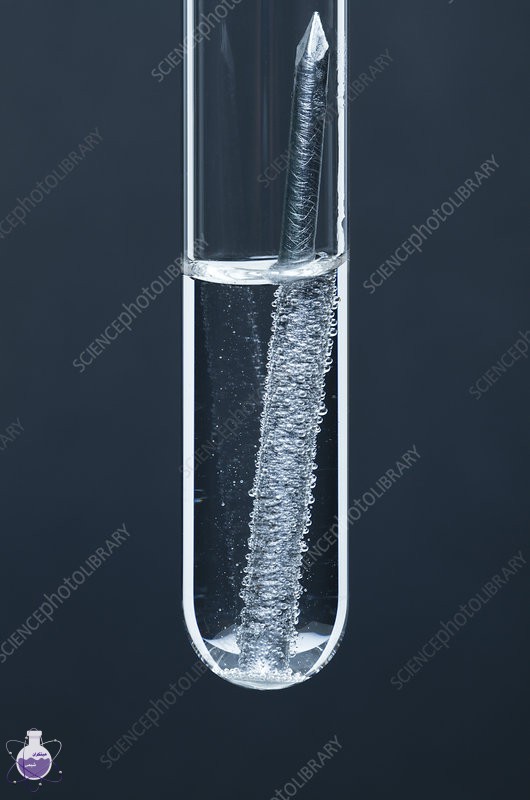
واکنش آهن با اسید سولفوریک
واکنش های این ماده با آهن بر اساس غلظت متفاوتند،
اگر رقیق باشد:
Fe+H2SO4⟶FeSO4+H2
اگر غلیظ باشد:
3Fe+8H2SO4⟶FeSO4+Fe2(SO4)3+4SO2+8H2O
رقیق سازی
برای رقیق کردن محلول غلیط این ماده با آب مقطر باید به نکات زیر توجه داشت:
- استفاده از این ماده باید کاملا در شرایط کنترل شده و بر اساس دستورالعمل های ایمنی استاندارد باشد.
- ابتدا با توجه به غلظت اولیه اسید موجود و غلظت مورد نظر، میزان دقیق اسید مصرفی و آب مقطر محاسبه گردد.
- acid را باید به آرامی به آب اضافه کرد و همزمان محلول را نیز باید به صورت پیوسته همزد تا از تجمع اسید در ته ظرف و ایجاد گرادیان دمایی جلوگیری شود.
انواع مختلف اسید سولفوریک موجود در بازار
این ماده مایعی بی رنگ و محلول در آب می باشد. در نتیجه با توجه به کاربرد مورد نظر این ماده را می توان با آب رقیق کرد و در غلظت های گوناگونی تهیه نمود. این ماده به صورت غلیظ به شدت خورنده است و می تواند موجب آسیب به بافت ها و خوردگی فلزات شود. تماس این ماده با پوست موجب سوختگی های خفیف تا شدید ( وابسته به غلظت مورد استفاده) می گردد. فلوئورو سولفوریک اسید پیش از کشف سوپر اسید ها قوی ترین اسید شناخته شده بود. اما امروزه و با کشف این مواد مشخص گشته است که سوپر اکسید ی مانند کربن صدها برابر قوی تر از (HFSO3) می باشد ( قوی بودن در این مقایسه به قابلیت خوردگی مواد ارتباطی ندارد).
کربن سوپراسید یک دهنده ی قوی پروتون به حساب می آید و می تواند واکنش های شیمیایی قوی تری نسبت به سایر acid ها ایجاد کند اما دلیلی بر قابلیت خوردگی آن ندارد. اگر شما دنبال ماده ای با قابلیت خوردگی بالایی می گردید بهترین گزینه هیدروفلوئوریک اسید است. HF با خوردگی بالایی که دارد می تواند شیشه را نیز حل نماید.
روش تولید
فرایند تولید سولفوریک اسید در چهار مرحله انجام می شود.
الف) استخراج گوگرد
ب) تبدیل گوگرد به دی اکسید گوگرد
ج) تبدیل دی اکسید گوگرد به تری اکسید گوگرد
د) تبدیل تری اکسید گوگرد به محصول مورد نظر
- استخراج
مهم ترین منبع این ماده گاز های طبیعی و روغن ها می باشند. ترکیبات آلی و سولفید هیدروژن موادی هستند که حتما پیش از استفاده به عنوان سوخت باید حذف شوند و می توانند منابع خوبی برای گوگرد باشند.
منبع مهم دیگر گوگرد به عنوان دی اکسید گوگرد حاصل از پالایش فلز است. بسیاری از سنگهای فلزی به عنوان سولفیدها وجود دارند و برای تشکیل اکسید فلزی و دی اکسید گوگرد با اکسیژن واکنش داده می شوند. در زیر می توانید این واکنش را برای سرب مشاهده نمایید.
2PbS+3O2->2PbO+2SO2
از سایر فلزاتی که همانند سرب منجر به تولید دی اکسید گوگرد می گردند می توان به نیکل، مس و روی اشاره نمود
در حدود 35 درصد گوگرد به عنوان دی اکسید گوگرد و از سنگ های معدن حاوی گوگرد به دست می آید
چین بیشترین تولید این ماده را از سنگ پیریت،سنگ معدن سولفید آهن انجام می دهد
لازم به ذکر است که در ساخت پلی (متیل 2-متیل پروپنوات) H2SO4 می تواند به عنوان محصول جانبی از سولفات آمونیوم نیز حاصل گردد.
- تبدیل گوگرد به دی اکسید گوگرد
اگر گوگرد ماده اولیه باشد ، ابتدا باید به دی اکسید گوگرد تبدیل شود. برای انجام این فرایند گوگرد مذاب را به درون کوره اسپری می نمایند و در دمای 1300 کلوین می سوزانند ( گوگرد به رنگ آبی می سوزد).
S+O2->SO2
با استفاده از افزودن هوای اضافی ، مقدار گازهای موجود برحسب حجم به حدود 10-12٪ دی اکسید گوگرد و 10٪ اکسیژن می رسد. این گازها بسیار داغ هستند و به همین دلیل از مبدلهای حرارتی (دیگهای بخار) عبور می کنند.
گاز ها تا 700 کلوین خنک می شوند و موجب بخار آب های موجود در بویلر ها می شوند
لازم به ذکر است که در ساخت یک تن از محصول فوق، یک تن بخار آب با فشار بالا تولید می شود.
- تبدیل سولفور دی اکسید به تری اکسید
با کمک راکتور بستر ثابت و حاوی 4 بستر حاوی کاتالیزور که به عنوان مبدل عمل می نمایند دمایی در حدود 700 کلوین اعمال می شود و سولفور دی اکسید و هوا از آن عبور داده می شود
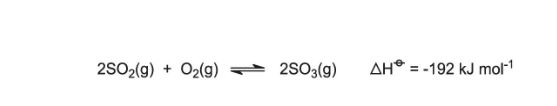
در این فرایند از وانادیوم (V) بر روی بستر سیلیس به عنوان کاتالیست و سولفات سزیم به عنوان پروموتر کمک گرفته می شود. عملکرد پروموتر پایین آوردن نقطه ذوب اکسید وانادیوم (V) است و منجر می شود تا این ماده در دمای 700 K ذوب شود.
- مرحله چهارم و نهایی
تری اکسید گوگرد تشکیل شده از بستر سوم (و مقدار کمی از بستر چهارم) در این مرحله به محصول مورد نظر تبدیل می شود.
در این مرحله تری اکسید گوگرد با آب وارد واکنش می شود. این واکنش را می توان به صورت زیر نشان داد:
SO3+H2O->H2SO4
کاربرد اسید سولفوریک
به طور کلی مصارف این ماده را به صورت زیر می توان دسته بندی نمود
- کود
- باتری
- دارو ها
- رنگ
- کاغذ
- پلاستیک
- آماده سازی فلزات
- شوینده ها
و…
بیشترین مصرف این محصول برای تولید اسید فسفریک است که به نوبه خود برای تهیه کودهای فسفاته شامل کلسیم دی هیدروژن سولفات و آمونیوم فسفات، مورد استفاده قرار می گیرد. همچنین برای تهیه سولفات آمونیوم نیز از آن استفاده می کنند.
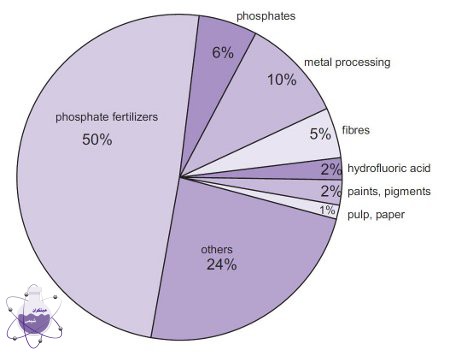
در فرآیندهای مربوط به فلزات از این ماده به صورت گسترده ای استفاده می شود، به عنوان مثال در تولید مس و روی و همچنین در پاک سازی سطح ورقه های فولاد از H2SO4 استفاده می کنند. از بین کاربردهای وسیع این ماده در صنعت می توان به استفاده در تولید اسید هیدروفلوئوریک و فنل که اشاره کرد که خود این مواد نیز در تولید بسیاری از مواد دیگر نقش دارند.
در بین سال های 2011-2012 حدود 231 میلیون تن از این ماده در جهان تولید شده که بزرگترین آن کشور چین بوده است. تولید این ماده هر سال افزایش یافته به طوری که شاهد رشد تقاضای جهانی این ماده با نرخ 2.5 % تا سال 2022 خواهیم بود. در حال حاضر بزرگترین بازار مصرفی جهان برای این اسید چین و سپس آمریکا هستند.
برای تولید مواد شوینده و رنگ ها از این اسید به عنوان عامل خشک کننده استفاده می کنند.
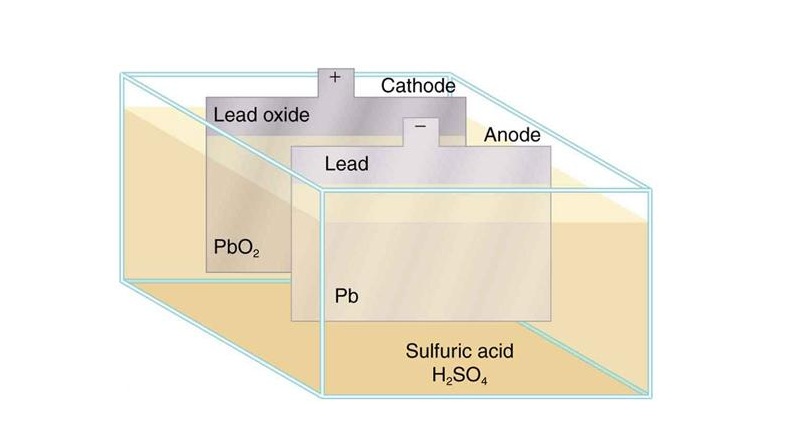
باتری ها
اسید سولفوریک جز اصلی در انواع مختلف باتری است. اسید باتری حاوی 35 درصد H2SO4 می باشد. از انواع این باتری ها می توان به باتری های با قدرت زیاد مانند باتری های موجود در تجهیزات تصویر برداری بیمارستانی ، باتری های ماشین ، باتری های تجهیزات کشاورزی و… اشاره نمود. باتری هایی از این قبیل معمولا بر پایه ی واکنش های شیمیایی بین سرب و H2SO4 می باشد. الکترون های تولید شده از این واکنش شیمیایی ، ولتاژ مورد نیاز باتری را فراهم می کنند. در این باتری ها الکترود مثبت از دی اکسید سرب ساخته می شود و الکترود منفی از سرب خالص تشکیل شده است. ماده ی فوق به صورت رقیق به عنوان الکترولیت عمل می نماید.
هنگام دشارژ غلظت الکترولیت با حذف یون های سولفات و تولید آب کاهش می یابد. این اثر را با اندازه گیری وزن مخصوص با کمک هیدرومتر مورد بررسی قرار می دهند. وزن مخصوص برای خودرو هایی که دارای باتری ساکن می باشند معمولا 1.275–1.285;و 1.200–1.215 می باشد
PbO2+2H2SO4+Pb⇌ChargeDischargePbSO4+2H2O
کاربرد در کشاورزی
در کشاورزی از این ماده برای خنثی کردن یون های بی کربنات و همچنین تنظیم pH خاک، استفاده می کنند. قیمت مناسب و کارایی عالی از عوامل محبوبیت این ماده در بین کشاورزان است.
باز کردن لوله های فاضلاب
یکی از کاربرد های خانگی اسید سولفوریک که موجب شده است این ترکیب در اغلب مغازه های لوله کشی نیز موجود باشد کاربرد آن در باز کردن لوله های فاضلاب است. این لوله باز کن ها در انواع جامد و مایع موجود می باشند، نوع جامد آن به صورت پودری برای فعال نمودن نیاز به آب سرد دارد
برای استفاده از این مواد لازم است تا مقدار مناسب درون لوله بریزید و سپس آب سرد را باز کنید تا مواد شیمیایی موجود در محصول فعال شوند. اگر مقداری از این ماده بر روی پوستتان ریخت هرگز آن را با آب سرد شست و شو ندهید در عوض پوست خود را با صابون بشویید و با آب گرم آبکشی نمایید
صنایع غذایی
این ماده در صنعت غذایی برای کنترل pH مورد استفاده قرار می گیرد. ترکیب فوق به صورت رقیق با گرید خوراکی E513 به عنوان افزودنی شناخته می شود. از کاربرد های عمده ی این ماده می توان به استفاده از این ترکیب در تولید پنیر، تصفیه ی شکر و تصفیه ی آب اشاره نمود. خاصیت اسیدی این ماده می تواند پروتئین ها و کربوهیدرات ها را تجزیه نماید. این ویژگی در فرایند پردازش نشاسته و آب پنیر مورد استفاده قرار می گیرد.
اسید شویی
این ماده می تواند در حذف ناخالصی های سطح فولاد اثر بخش باشد. HCl نیز قابلیت اسیدشویی دارد اما به دلیل قیمت پایین تر این محصول استفاده از ان در بعضی کاربری ها بر HCl برتری دارد.
تولید سولفات کبالت
همچنین این ماده در تولید سولفات کبالت (خرید سولفات کبالت) نیز کاربرد دارد.
نساجی
پارچه های ریون از الیاف سلولزی دریافتی از چوب به دست می آیند.
این الیاف در محلول تترا آمین مس حل می شوند تا یک مایع غلیظ آبی تشکیل شود.
سپس به H2SO4 تزریق می گردند تا الیاف ریون ساخته شود. ریون الیافی نیمه مصنوعی به حساب می آید و می تواند در پارچه های ابریشمی موجب درخشندگی آن شود.
ابریشم به دلیل رنگ پذیری عالی، نرمی و زیبایی از مرغوبترین پارچه های موجود به حساب می آید. با این حال ریون موجب حفظ حرارت بدن نمی شود و استفاده از این الیاف در کشور های گرم و مرطوب بیشتر مورد استفاده قرار می گیرد
پالایش نفت
در صنعت پالایش نفت معمولا از یک اسید به عنوان کاتالیست استفاده می گردد.اسید سولفوریک یکی از این کاتالیست های مهم است. این ماده در واحد SAAU و یا واحد آلکیلاسون H2SO4 مورد استفاده قرار می گیرد.
بازار جهانی خرید و فروش سولفوریک اسید
تا سال 2012 ، تولید جهانی این ماده بیش از 250 میلیون تن و تا سال 2018، 260 میلیون تن یوده است. همچنین پیش بینی می شود روند صعودی رشد این ماده حداقل تا سال 2023 حفظ شود.
MSDS و خطرات این اسید کدامند ؟
- تماس با چشم: درد، سوختن و آسیب شدید که موجب کورشدن دائمی می گردد.
- تماس با پوست: باعث سوختگی و تورم شدید می شود، می تواند سوختگی درجه سوم در پوست بوجود آورد.
- استنشاق: التهاب سیستم تنفسی، در غلظت های بالا باعث آسیب های جدی و حتی مرگ می شود.
- بلعیدن: موجب التهاب و سوختگی شدید در دهان گلو و سیستم گوراشی می گردد.
در شکل زیر اقدامات لازم در هنگام تماس ناگهانی را می توانید مشاهده نمایید :

اقدامات اولیه
- پوست و چشم: محل را را با آب روان حداقل به مدت 20 دقیقه باید شستشو داد، تا تمام نشدن این دوره نباید مصدوم را تکان داد. چشم آلوده را باید با آب روان حداقل به مدت 20 دقیقه شستشو داد، در این مدت چشم فرد باید باز نگه داشته شود، سریعا باید مراقبت های پزشکی را خبر کنید، تا تمام نشدن این دوره نباید مصدوم را تکان داد.
- استنشاق و بلع: مصدوم را به هوای تازه ببرید، فقط در صورت توقف تنفس به مصدوم تنفس مصنوعی بدهید، از تنفس دهان به دهان خودداری و از ماسک اکسیژن استفاده شود، سریعا باید مراقبت های پزشکی را خبر کنید. در صورت بلع، مصدوم را به هیج وجه مجبور به استفراغ نکنید، در صورت امکان نیم لیتر آب به مصدوم بدهید، در صورت استفراغ خود به خودی سر مصدوم را به جلو برده و پس از تمام شدن، دهان و سایر نقاط آلوده را با آب بشویید، سریعا به مراکز درمانی خبر دهید.
















نقد و بررسیها
هنوز بررسیای ثبت نشده است.